Опиоиды в онкологии. Адекватное применение и оценка рисков

Морфин и другие опиоиды являются основой лечения боли у онкологических пациентов. В 1986 году ВОЗ предложила простую трехэтапную модель для облегчения боли при раке (рисунок 2a). ВОЗ подчеркивает, что «облегчение психологических, социальных и духовных проблем имеет первостепенное значение» [1].
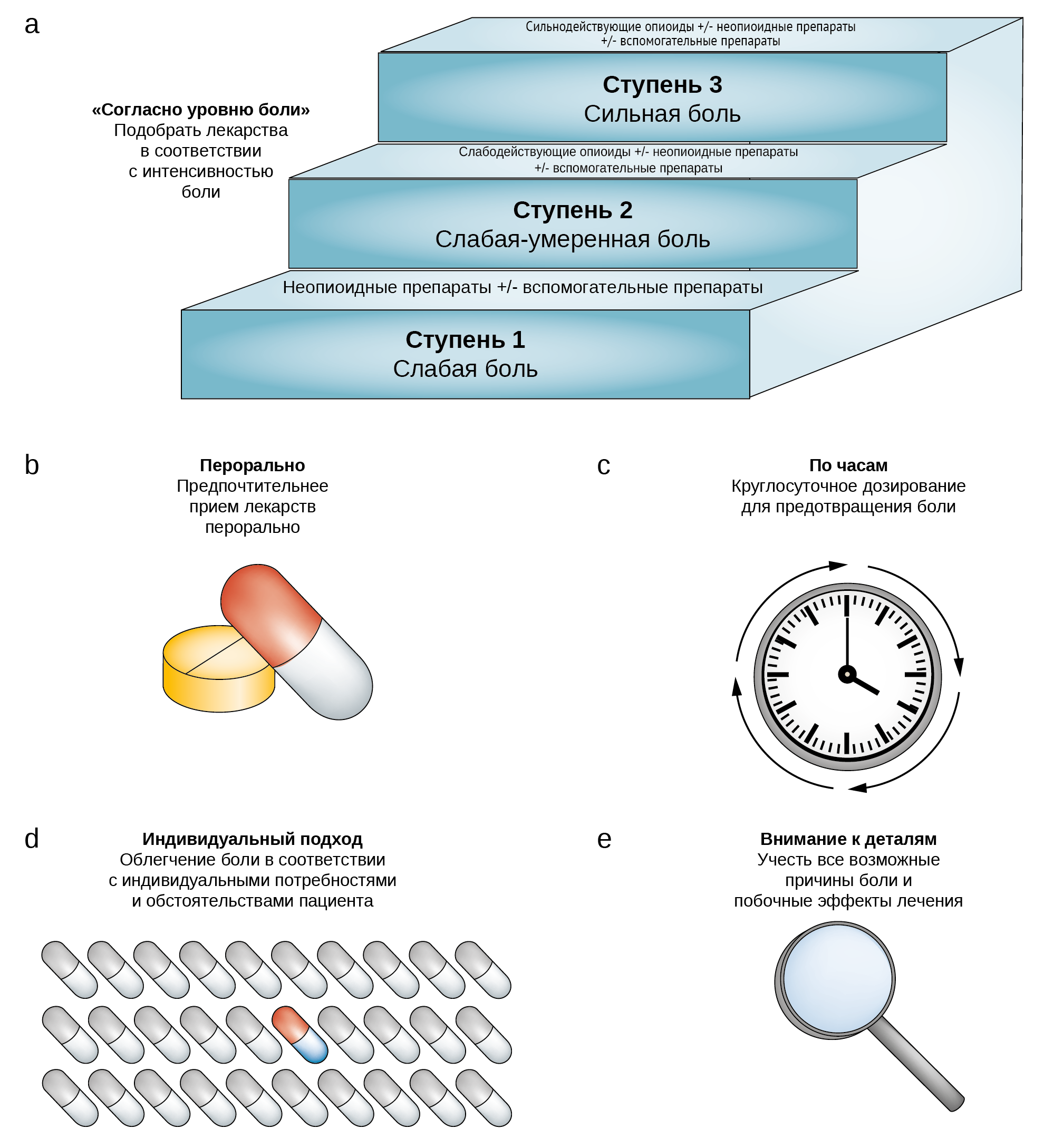
Рис. 1 | Принципы ВОЗ по применению анальгетиков для обезболивания при раке: a) согласно уровню боли b) перорально с) по часам d) индивидуальный подход и е) внимание к деталям. (ВОЗ 1986)
Основные виды онкологической боли
Острая онкологическая боль
- Ассоциированная с опухолью: патологический перелом, обструкция или перфорация полого органа, перфорация верхней полой вены.
- Ассоциированная с противоопухолевой терапией: мукозит, головная боль, ладонно-подошвенный синдром, миалгия и артралгия.
- Ассоциированная с радиотерапией: мукозит, боль в костях, нейропатия.
- Острая послеоперационная боль.
Хроническая онкологическая боль
- Ассоциированная с опухолью:
- боль в костях — метастазы, инфильтрация в костный мозг;
- боль в мягких тканях — головная боль, лицевая боль, плевральная боль;
- висцеральная боль — увеличение печени, хроническая кишечная непроходимость, боль в промежности.
- Невралгия черепных нервов: глоссофарингеальная невралгия, невралгия тройничного нерва.
- Плексопатии: плечевая, пояснично-крестцовая и шейная.
- Радикулопатии: пояснично-крестцовая, шейная и грудная.
- Нейропатия: паранеопластическая сенсорная нейропатия.
- Боль, ассоциированная с химиотерапией: аваскулярный некроз, компрессионные переломы позвонков, периферическая нейропатия.
- Хирургическая боль: лимфедема, постторакотомическая боль, фантомная боль после ампутации, постмастэктомическая боль.
- Боль, ассоциированная с радиотерапией: цистит, энтерит или проктит, остеорадионекроз и переломы; болезненные вторичные злокачественные новообразования, плечевая и пояснично-крестцовая плексопатии.
- Боль, ассоциированная с гормональной терапией: артралгии, миалгии, диспареуния, гинекомастия, остеопоротические компрессионные переломы.
Опиоиды связываются с опиоидными рецепторами ноцицептивного пути, чтобы уменьшить передачу импульсов и восприятие боли в соматосенсорной коре. Препараты опиоидов включают морфин, оксикодон, гидрокодон, трамадол, гидроморфон, оксиморфон, фентанил, бупренорфин и метадон [2].
Морфий. Считается препаратом номер один при боли, связанной с онкопатологией, главным образом потому, что он является относительно более распространенным и доступным, но не более эффективным, чем другие опиоиды [3].
Метадон. Использование и титрование метадона является сложной задачей и должно осуществляться профессионалами с высоким уровнем знаний, например, специалистами в области паллиативной помощи и обезболивания [3].
Бупренорфин. Были высказаны опасения по поводу эффективности бупренорфина из-за его частичной агонистической активности, что может приводить к снижению обезболивающего эффекта и увеличивать вероятность побочных эффектов при более высоких дозах. Некоторые исследования показали, что этот препарат безопасен и эффективен при лечении хронической боли, связанной с раком [4], и предложили его в качестве альтернативы морфину, оксикодону и фентанилу [5]. Препараты бупренорфина для парентерального применения, а также низкодозированные трансдермальные препараты бупренорфина одобрены для лечения хронической боли онкологического генеза средней и тяжелой степени [6].
Способы применения
Пациентам необходимо иметь доступ как к опиоидам замедленного высвобождения, так и к лекарствам немедленного действия для купирования эпизодов острой сильной боли. Препаратами выбора обычно являются таблетированные формы с пролонгированным высвобождением в связи с возможностью назначения пациентам более низких дозировок, более длительным анальгетическим эффектом и меньшим влиянием на сон по сравнению с препаратами немедленного высвобождения, однако их стоимость может ограничивать возможности пациентов по их приобретению [3].
Также опиоиды с разной скоростью высвобождения действующего вещества имеют различные побочные эффекты. Препараты с немедленным высвобождением сильнее действуют на лимбическую систему, быстрее вызывают эйфорию, чем препараты с пролонгированным высвобождением. Опиоидные анальгетики пролонгированного действия могут быть рассмотрены для лечения пациентов с хронической онкологической болью, в том числе с немедицинским использованием опиоидов в анамнезе [2].
Трансдермальный путь введения препаратов (фентанил, бупренорфин) используется у пациентов, которые не способны принимать лекарственные средства внутрь. Подкожный путь применяется у пациентов, которые не могут получать опиоиды пероральным или трансдермальным путем. Внутривенный способ введения следует учитывать при необходимости титрования опиоидов или с целью быстрого обезболивания. Введение опиоидов ректально также может быть эффективно, но ограничивается доступностью соответствующих препаратов и желанием пациента [3].
Ингаляционные опиоиды и опиоиды для внутривенного введения попадают в кровоток и проникают через гематоэнцефалический барьер быстрее. Было доказано, что применение лекарств путем ингаляций и внутривенных инъекций ассоциировано с увеличением риска возникновения расстройств, связанных с употреблением психоактивных веществ, и передозировки [11].
Доза
Клиницистам следует выбирать минимальную эффективную дозу опиоида, которая будет вызывать желаемую анальгезию с незначительными или отсутствующими побочными эффектами. Многочисленные исследования показали, что назначения высоких доз опиоидов (обычно > 100 мг в день) связаны с повышенным риском злоупотребления [12] и/или передозировки у пациентов как с хронической онкологической болью, так и с другими видами хронического болевого синдрома [13]. В рекомендациях Центра по контролю и профилактике заболеваний США по части лечения неонкологической боли сказано, что врачи должны избегать применения дозировок > 90 мг в день [9]. Однако дозовые и временные пределы не всегда подходят для пациентов с хронической онкологической болью, которым часто требуются повышенные дозы в течение длительных периодов времени [2].
Побочные эффекты
К побочным эффектам опиоидов относятся запоры, тошнота и рвота, зуд, седация, опиоидная нейротоксичность и угнетение дыхания. Побочные эффекты, связанные с опиоидами, можно контролировать путем уменьшения дозы, применения опиоидов другой группы, изменения пути введения или симптоматического устранения побочных эффектов. Одновременное использование антигистаминных препаратов, анксиолитиков или габапентиноидов для лечения симптомов, сопутствующих боли, может усиливать опиоидную токсичность [2].
Опиоид-сберегающие средства
Адъювантные анальгетики, включая противосудорожные средства, такие как амитриптилин и габапентин, считаются особенно эффективными при нейропатической боли, но их необходимо тщательно подбирать для предотвращения усиления побочных эффектов со стороны центральной нервной системы при одновременном применении с опиоидами. Габапентин при нейропатической боли стоит использовать с осторожностью: необходимы дополнительные исследования для оценки эффективности и безопасности этого препарата. НПВС и ацетаминофен могут использоваться в качестве опиоид-сберегающих средств при боли в костях при отсутствии противопоказаний [2].
Пациенты подвергаются повышенному риску передозировки опиоидами в ранний период начала опиоидной терапии или позже — вследствие развития толерантности к опиоидам. Пациенты с эпизодами немедицинского использования опиоидов и психическими расстройствами, связанными с употреблением психоактивных веществ в анамнезе, чрезвычайно уязвимы в плане развития передозировки данными препаратами после периода воздержания: при сохранении постоянного желания употребления опиоидов, они утрачивают чувствительность к ним, которая ранее препятствовала седации и угнетению дыхания. Потеря толерантности к опиоидам обычно происходит в течение нескольких дней после прекращения приема препарата, в то время как тяга, связанная с немедицинским применением опиоидов и расстройствами, связанными с употреблением психоактивных веществ, может сохраняться месяцы и годы [10].
Большинство руководств по назначению опиоидов [9,14,15] поощряют оптимизированное использование неопиоидных и адъювантных анальгетиков [3,14,15].
Назначение налоксона
Налоксон — опиоидный антагонист короткого действия, используемый как антидот при передозировке опиоидами, помогающий снизить риск угнетения дыхания; может быть полезен для пациентов с риском эпизодов немедицинского использования опиоидов [2].
Расстройства, связанные с употреблением психоактивных веществ
Механизм
Ноцицептивная информация о повреждении периферических тканей передается через афферентное нервное волокно к дорсальному рогу спинного мозга, где он образует синапс со вторым нейроном и далее позволяет импульсу перемещаться вверх по спинному мозгу. Затем нейрон второго порядка образует синапс с нейроном третьего порядка в таламусе, который, наконец, отправляет информацию в соматосенсорную кору, что приводит к восприятию интенсивности боли [7]. В дополнение к этому основному спиноталамическому пути ноцицептивный импульс также передается по другим путям, что приводит к возбуждению и/или нарушению сна, отрицательным эмоциям, связанными с наличием боли и планированием лечения [8] (Рис. 2).
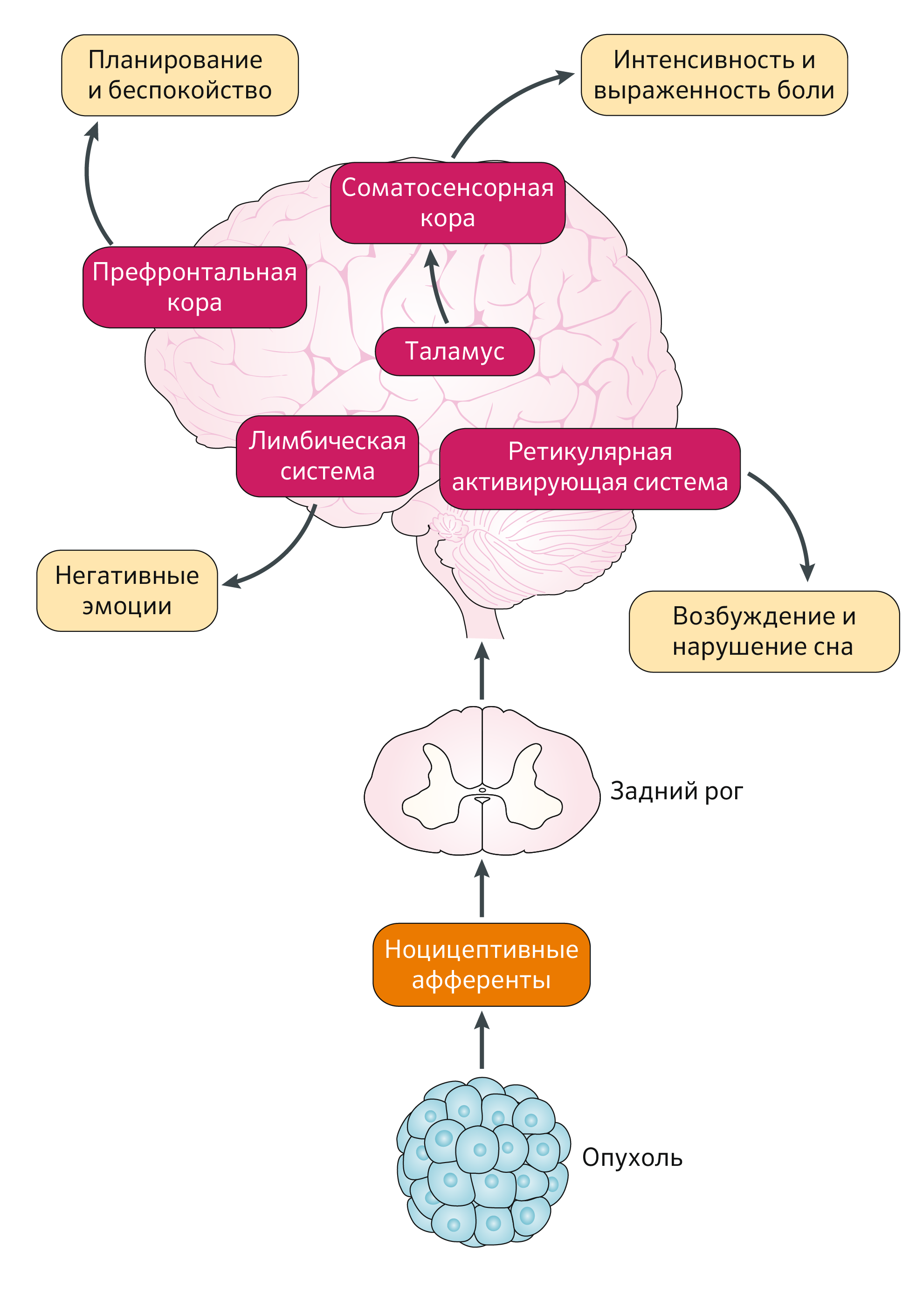
Экспрессия μ-опиоидных рецепторов обнаруживается во всей нервной системе, включая периферию, спинной мозг, таламус, соматосенсорную кору, средний мозг и лимбическую систему, и опиоиды связываются с любым μ-опиоидным рецептором, который они обнаруживают. Стимуляция μ-опиоидного рецептора в вентральной области покрышки среднего мозга и прилежащего ядра в вентральном стриатуме приводит к выделению дофамина, опиоидных пептидов и серотонина (Рис. 3) [8].
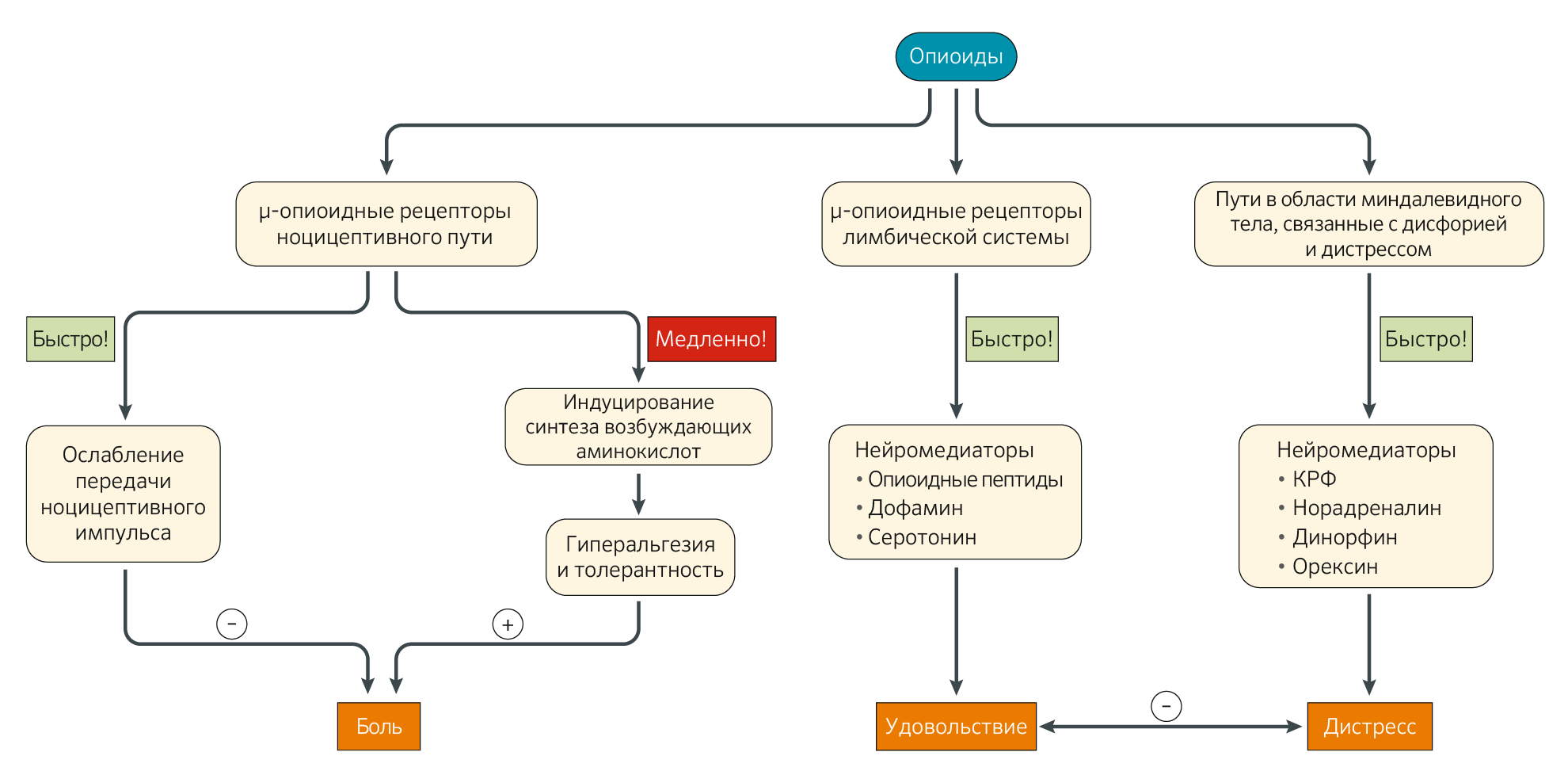
Эти нейротрансмиттеры приводят к эйфории и тем самым уменьшают негативные последствия боли и других переживаний, связанных с диагностикой рака, страхом смерти, потерями и/или семейными, личными или финансовыми проблемами. Пациенты с относительно более высокой концентрацией μ-опиоидного рецептора в их лимбической системе испытывают особенно интенсивную реакцию в ответ на введение опиоидов [19]. Это может привести их к немедицинскому употреблению опиоидов. Постепенно высвобождение нейротрансмиттеров, связанных с удовольствием после приема опиоидов, уменьшается, и высвобождение нейротрансмиттеров в миндалине, связанных с дисфорией и стрессом, увеличивается [8]. Эти нейротрансмиттеры включают кортикотропин-рилизинг-фактор, норадреналин, динорфин и орексин. В результате пациенты стремятся увеличить дозы опиоидов ввиду все большего накопления μ-опиоидных рецепторов в лимбической системе. Со временем пациенты, у которых в конечном итоге разовьется психическое расстройство, связанное с употреблением психоактивных веществ, будут увеличивать потребление опиоидов не только для восстановления эффекта эйфории, но и для предотвращения этих дисфорических ощущений и просто для восстановления состояния «нормальности» [2].
Расстройство, вызванное употреблением психоактивных веществ определяется 11 диагностическими критериями, охватывающими четыре основные области: признаки нарушения контроля, социальные нарушения, рискованное использование и фармакологические критерии. Расстройство, связанное с употреблением психоактивных веществ может быть классифицировано как легкое (2–3 критерия), среднее (4–5 критериев) или тяжелое (≥ 6 критериев) [16].
Поведение, ассоциированное с немедицинским использованием опиоидов (НМИО) [2]:
- частые незапланированные встречи с врачом или телефонные звонки с просьбой предоставить рецепты на опиоиды;
- требование чрезмерно большой дозы опиоидов, которая не соответствует выраженности болевого синдрома пациента;
- сообщения о потерянных или украденных рецептах;
- частые посещения отделения неотложной помощи с целью получить опиоиды;
- поиск пациентом опиоидов в нескольких источниках;
- запросы на определенный опиоид;
- устойчивость к изменениям в режиме приема опиоидов даже при клинических показаниях;
- использование нерегламентированных препаратов с ограниченным доступом или запрещенных препаратов;
- требование выписать опиоиды для достижения эйфории или для лечения таких симптомов как беспокойство или бессонница;
- сообщения о наличии проблем в повседневной жизни из-за употребления опиоидов;
- члены семьи и/или лица, обеспечивающие уход, выражают беспокойство по поводу использования пациентом опиоидов;
- найденные у пациента запасы наркотиков;
- получение опиоидов из немедицинских источников;
- сообщения о краже, фальсификации или подделке рецептов на опиоиды;
- несоответствие количества принятых лекарств и выписанных, отсутствие этому объяснения.
Текущий мониторинг
Научно обоснованные рекомендации по безопасному назначению опиоидов у пациентов с онкологической болью ограничены [9,14,15]. Американское общество онкологии разработало рекомендации по лечению боли у людей, переживших рак [14], а Национальная всеобщая онкологическая сеть США выпустила рекомендации по лечению боли, связанной с раком у взрослых [17]. Существующие данные предлагают универсальный подход к мерам предосторожности, состоящий из первоначального скрининга всех пациентов с раковой болью, которым требуются опиоиды, с использованием инструментов для оценки риска [2].
Пациентам, имеющим высокий риск немедицинского использования опиоидов, потребуется усиленный мониторинг. До начала приема опиоидов врачи должны информировать пациентов о потенциальных рисках, преимуществах, альтернативах и возможных побочных эффектах, связанных с опиоидной терапией, а также информировать их о безопасных методах использования, хранения и утилизации опиоидов [14]. Выбор, начальная дозировка и поддерживающие дозы опиоидов должны быть адаптированы к индивидуальным особенностям пациента, таким как уровень интенсивности боли и наличие почечной или печеночной дисфункции [15]. Четкий план прекращения лечения опиоидами следует заранее обсудить с пациентом, если этиология боли предполагает ожидаемое время ее прекращения, например, связанный с лечением оральный мукозит у пациентов, перенесших трансплантацию стволовых клеток или лучевую терапию при раке головы и шеи [2].
Программы мониторинга отпускаемых по рецепту лекарств
Программы мониторинга отпускаемых по рецепту лекарств существуют в Северной Америке, Австралии и некоторых частях Европы. Эти программы собирают информацию о контролируемых веществах, отпускаемых по рецепту аптекой, анализируют ее в защищенной электронной базе данных и предоставляют эти данные уполномоченным пользователям, включая лица, назначающие препараты, регулирующие и правоохранительные органы. Программы мониторинга отпускаемых по рецепту лекарств показывают, когда и где пациенты получали рецепты на опиоиды, и кто их прописывал, а также позволяют идентифицировать пациентов, которые ищут опиоиды у некоторых лиц, назначающих лекарства («покупка в магазине») или заполняют несколько рецептов в разных аптеках («покупка в аптеке») [2].
Принятие мер
Меры, которые обычно применяются для решения проблем немедицинского применения опиоидов включают в себя следующее: четкое изложение шагов, которые необходимо предпринять при повторном несоблюдении режима приема лекарств, сокращение временного интервала между последующими получениями добавок для для обеспечения более частого и бдительного мониторинга, ограничения количества опиоидов и дозы пополнения, отмена опиоидов, когда это возможно, обращение к специалисту по боли, паллиативной медицине, психическому здоровью или наркомании для совместного ведения [15]. Информирование в отношении безопасного использования, хранения и утилизации опиоидов должно быть обеспечено как пациентам, так и лицам, осуществляющим уход за ними. Конечной целью опиоидной терапии у пациентов с эпизодами немедицинского употребления опиоидов является достижение приемлемого обезболивания, улучшение физической и психосоциальной функции и минимизация осложнений с целью оптимизации соотношения риск-польза для обеспечения безопасного использования опиоидов [2].
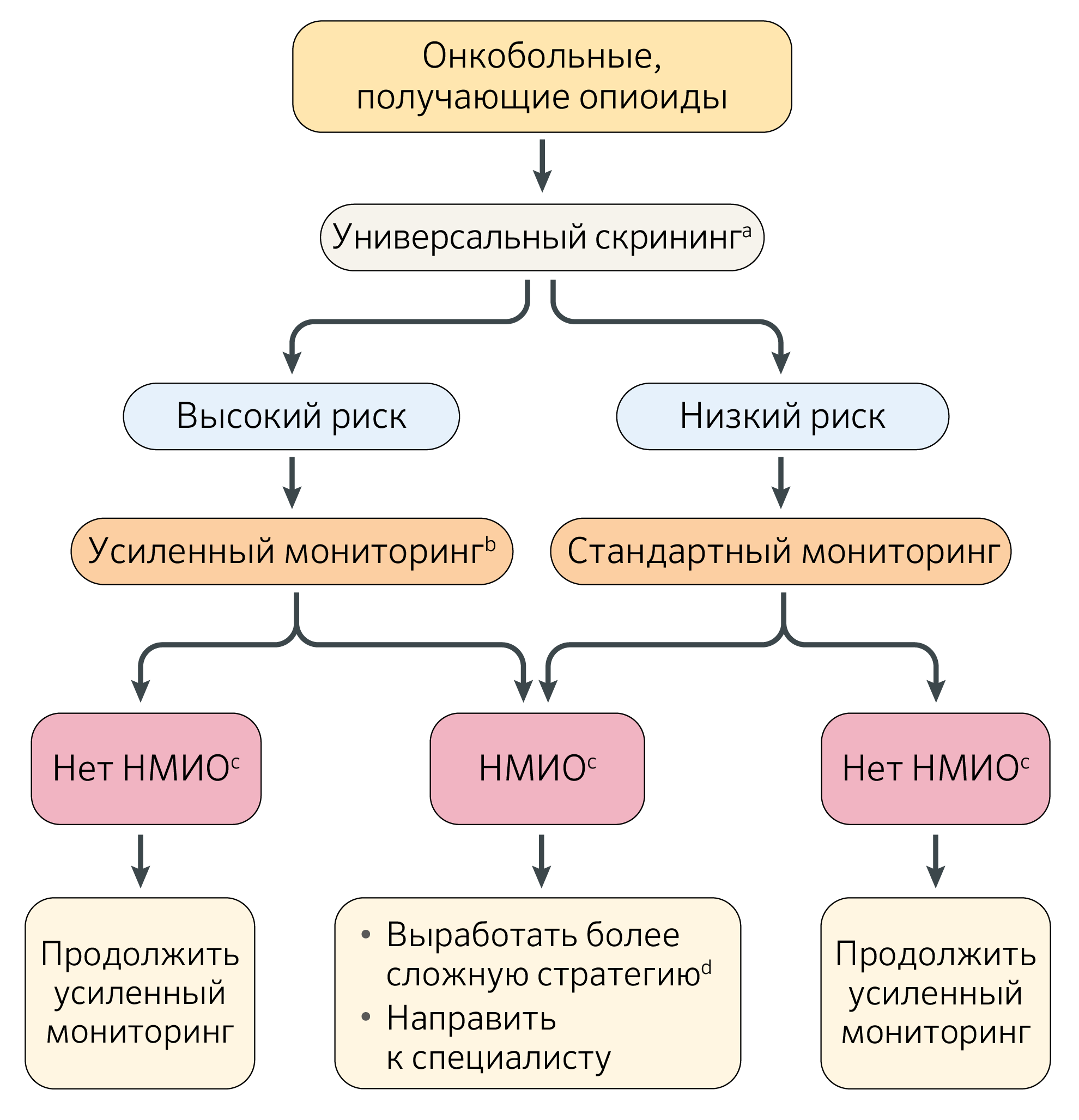
b) Усиленный мониторинг включает использование программ контроля отпускаемых по рецепту лекарств, выборочные анализы мочи на наркотики и тщательное наблюдение за поведением для выявления патологических признаков, связанных с употреблением опиоидов.
c) Немедицинское использование опиоидов (см. Поведение, ассоциированное с немедицинским использованием опиоидов)
d) Дополнительные стратегии включают в себя уменьшение временного интервала между контрольными исследованиями для повторных назначений, ограничение количества опиоидов и дозы добавок, установление ограничений, отмена опиоидов при первой возможности, обращение к специалисту для дальнейшего ведения.
НМИО — немедицинское использование опиоидов.
Назначение опиоидов в конце жизни
У пациентов с поздней стадией рака развивается ряд физических и психологических симптомов, и боль часто лечится в контексте множества сопутствующих проблем, таких как усталость, тошнота, эмоциональное расстройство и делирий. Более половины людей, замеченных в немедицинском применении опиоидов, получали опиоиды по рецепту от друга или родственника бесплатно, а 11 % покупали опиоиды у тех же лиц [18]. После эпидемии передозировки опиоидами были сделаны призывы к клиницистам пересмотреть практику назначения опиоидов пациентам в конце жизни. Для безопасного назначения опиоидов пока нет регламентированных условий, но, возможно, стоит обеспечить свободный законный доступ к опиоидам определенным лицам с неизлечимыми заболеваниями [2].
Литература:
- Dalal S., Bruera E. Access to opioid analgesics and pain relief for patients with cancer //Nature Reviews Clinical Oncology. – 2013. – Т. 10. – №. 2. – С. 108.
- Arthur J., Bruera E. Balancing opioid analgesia with the risk of nonmedical opioid use in patients with cancer //Nature Reviews Clinical Oncology. – 2018. – С. 1.
- Caraceni A. et al. Use of opioid analgesics in the treatment of cancer pain: evidence-based recommendations from the EAPC //The lancet oncology. – 2012. – Т. 13. – №. 2. – С. e58-e68.
- Pergolizzi J. et al. Current knowledge of buprenorphine and its unique pharmacological profile //Pain Practice. – 2010. – Т. 10. – №. 5. – С. 428-450.
- Schmidt‐Hansen M. et al. Buprenorphine for treating cancer pain //Cochrane Database of Systematic Reviews. – 2015. – №. 3.
- Foster B. et al. Buprenorphine //Journal of pain and symptom management. – 2013. – Т. 45. – №. 5. – С. 939-949.
- Renn C. L., Dorsey S. G. The Physiology and Processing of Pain A Review //AACN Advanced Critical Care. – 2005. – Т. 16. – №. 3. – С. 277-290.
- Koob G. F., Volkow N. D. Neurobiology of addiction: a neurocircuitry analysis //The Lancet Psychiatry. – 2016. – Т. 3. – №. 8. – С. 760-773.
- Dowell D., Haegerich T. M., Chou R. CDC guideline for prescribing opioids for chronic pain—United States, 2016 //Jama. – 2016. – Т. 315. – №. 15. – С. 1624-1645.
- Volkow N. D., McLellan A. T. Opioid abuse in chronic pain—misconceptions and mitigation strategies //New England Journal of Medicine. – 2016. – Т. 374. – №. 13. – С. 1253-1263.
- European Monitoring Centre for Drugs and Drug Addiction (EMCDDA). Preventing opioid overdose deaths with take‐home naloxone. – 2016.
- Comer S. D. et al. Abuse liability of prescription opioids compared to heroin in morphine-maintained heroin abusers //Neuropsychopharmacology. – 2008. – Т. 33. – №. 5. – С. 1179.
- Bohnert A. S. B. et al. Association between opioid prescribing patterns and opioid overdose-related deaths //Jama. – 2011. – Т. 305. – №. 13. – С. 1315-1321.
- Paice J. A. et al. Management of chronic pain in survivors of adult cancers: American Society of Clinical Oncology clinical practice guideline //Journal of Clinical Oncology. – 2016. – Т. 34. – №. 27. – С. 3325-3345.
- Chou R. 2009 Clinical Guidelines from the American Pain Society and the American Academy of Pain Medicine on the use of chronic opioid therapy in chronic noncancer pain: what are the key messages for clinical practice? //Polskie Archiwum Medycyny Wewnetrznej. – 2009. – Т. 119. – №. 7-8. – С. 469-477.
- American Psychiatric Association et al. Diagnostic and statistical manual of mental disorders (DSM-5®). – American Psychiatric Pub, 2013.
- National Comprehensive Cancer Network et al. NCCN clinical practice guidelines in oncology–adult cancer pain (version 1.2018) //NCCN https://www. nccn. org/professionals/physician_gls/pdf/pain. pdf. – 2018.
- Lipari R. N., Hughes A. How people obtain the prescription pain relievers they misuse //The CBHSQ report. – Substance Abuse and Mental Health Services Administration (US), 2017.
- Reed B. et al. Genetics of opiate addiction //Current psychiatry reports. – 2014. – Т. 16. – №. 11. – С. 504.
