Тепловой удар

Изменения температуры и влажности в связи с климатическими переменами влияют на условия жизни и работы. В исследовании, опубликованном в журнале The Lancet, ученые изучили влияние изменения климата на работоспособность и выживаемость людей в рамках эксперимента с климатическими моделями. Согласно результатам исследования, угрозы для нормальной работоспособности людей существенно возрастут с увеличением средней температуры поверхности земли в климатических моделях, при этом примерно 1 миллиард человек в мире окажется в зоне риска при повышении средней температуры поверхности земли на 2,5°C в сравнении с температурой поверхности в доиндустриальное время. Число людей, которые могут подвергнуться тепловому стрессу, превышающему порог выживаемости, достигнет примерно 20 миллионов человек во всем мире при глобальном увеличении температуры на 2,5°C. Такие оценки сделаны на основании медианы климатических моделей с учетом большой погрешности моделирования. Очевидно, что городские жители более подвержены тепловому стрессу, чем люди в сельской местности. Вопрос об оказании медицинской помощи при тепловом ударе, несомненно, является актуальным.
Определение и классификация теплового удара
Тепловой удар может быть обусловлен воздействием высокой температуры окружающей среды или напряженной физической нагрузкой. Отличия классического теплового удара и теплового удара, обусловленного физической нагрузкой, представлены в таблице 1.
.
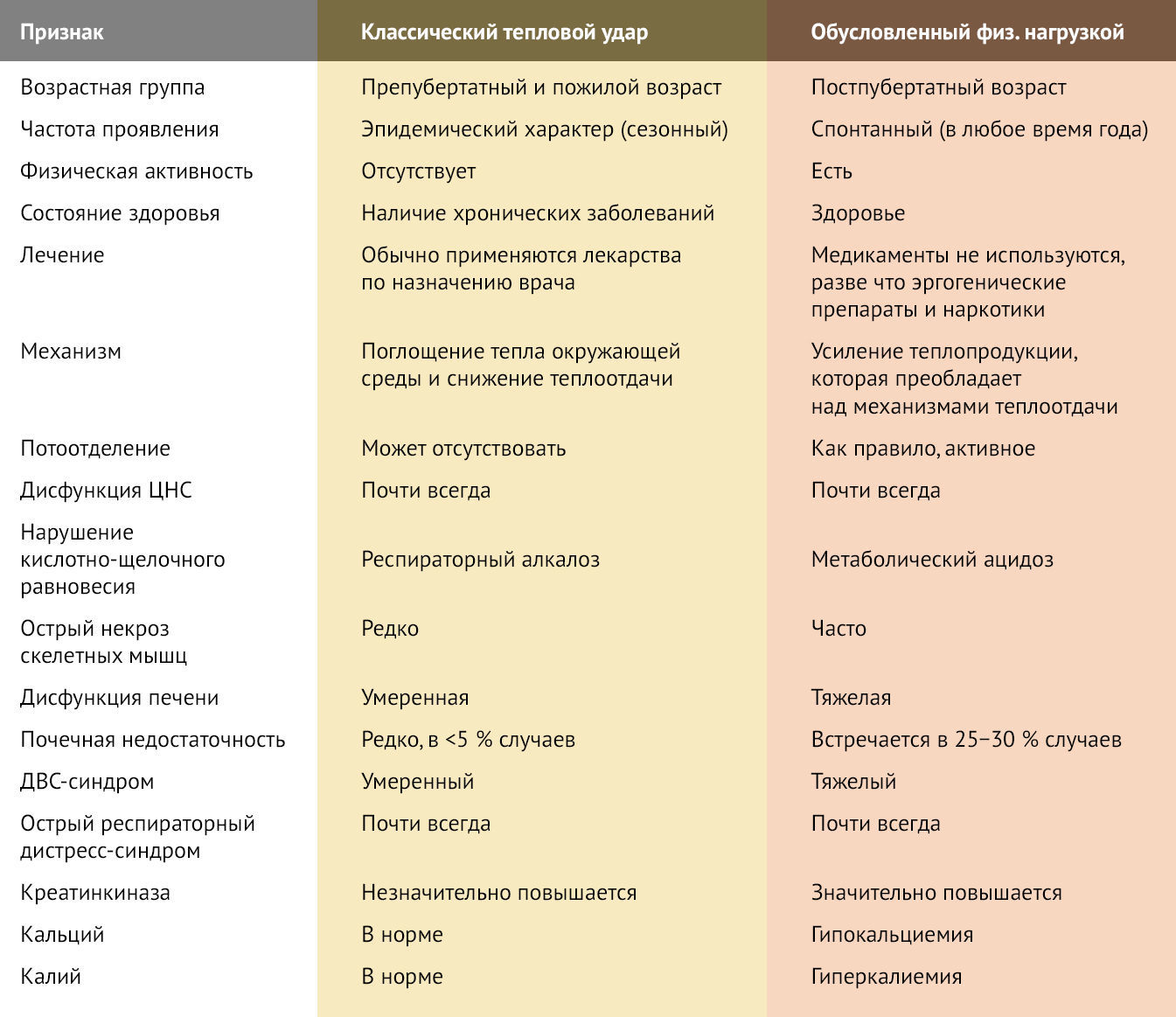
Таблица 1. Эпидемиологические и клинические особенности классического теплового удара и теплового удара, обусловленного физической нагрузкой.
Определение Абдеррезака Бушамы и критерии JAAM (Japanese Association For Acute Medicine — Японская ассоциация неотложной медицины) являются наиболее общепринятыми. Согласно определению Бушамы, тепловой удар — это повышение температуры внутри тела выше 40°C, сопровождающееся сухостью кожи и нарушениями функций центральной нервной системы, такими как бред, судороги или кома. Тепловой удар может являться формой гипертермии, связанной с системным воспалительным ответом, который приводит к синдрому полиорганной дисфункции.
Более современное определение теплового удара JAAM включает следующие критерии:
- ≤ 14 по шкале комы Глазго;
- уровень креатинина или общего билирубина ≥ 1,2 мг/дл;
- оценка стадии ДВС-синдрома по шкале JAAM ≥ 4.
Основы терморегуляции
Температура тела регулируется механизмом обратной связи, опосредованным нервной системой. Центр терморегуляции находится в гипоталамусе. Для обеспечения механизма обратной связи должна быть возможность обнаружить отклонения температуры от нормы. Преоптическая область переднего гипоталамуса содержит большое количество чувствительных к теплу и холоду нейронов (более 30 % всех чувствительных нейронов). Данные нейроны, предположительно, выполняют функцию термосенсоров, контролирующих температуру тела. Нейроны, чувствительные к теплу, при повышении температура тела на 10 градусов увеличивают частоту разряда в 2–10 раз. Нейроны, чувствительные к холоду, напротив, увеличивают частоту разряда при снижении температуры тела. При нагревании преоптической области вся поверхность кожи начинает покрываться потом вследствие резко выраженной дилатации сосудов кожи. Эта немедленная реакция обеспечивает теплоотдачу и позволяет вернуть температуру тела к нормальным значениям. Кроме того, блокируется избыточная теплопродукция. Таким образом, преоптическая область гипоталамуса выполняет функции центра, контролирующего постоянство температуры тела. Передняя доля гипоталамуса поддерживает температуру ядра тела на уровне 37°С. Несколько механизмов, связанных с потоотделением, такие как испарение, излучение, конвекция и проводимость, также функционируют для охлаждения поверхности тела.
Патогенез теплового удара
Патогенез теплового удара схематично представлен на рисунке 1.
.
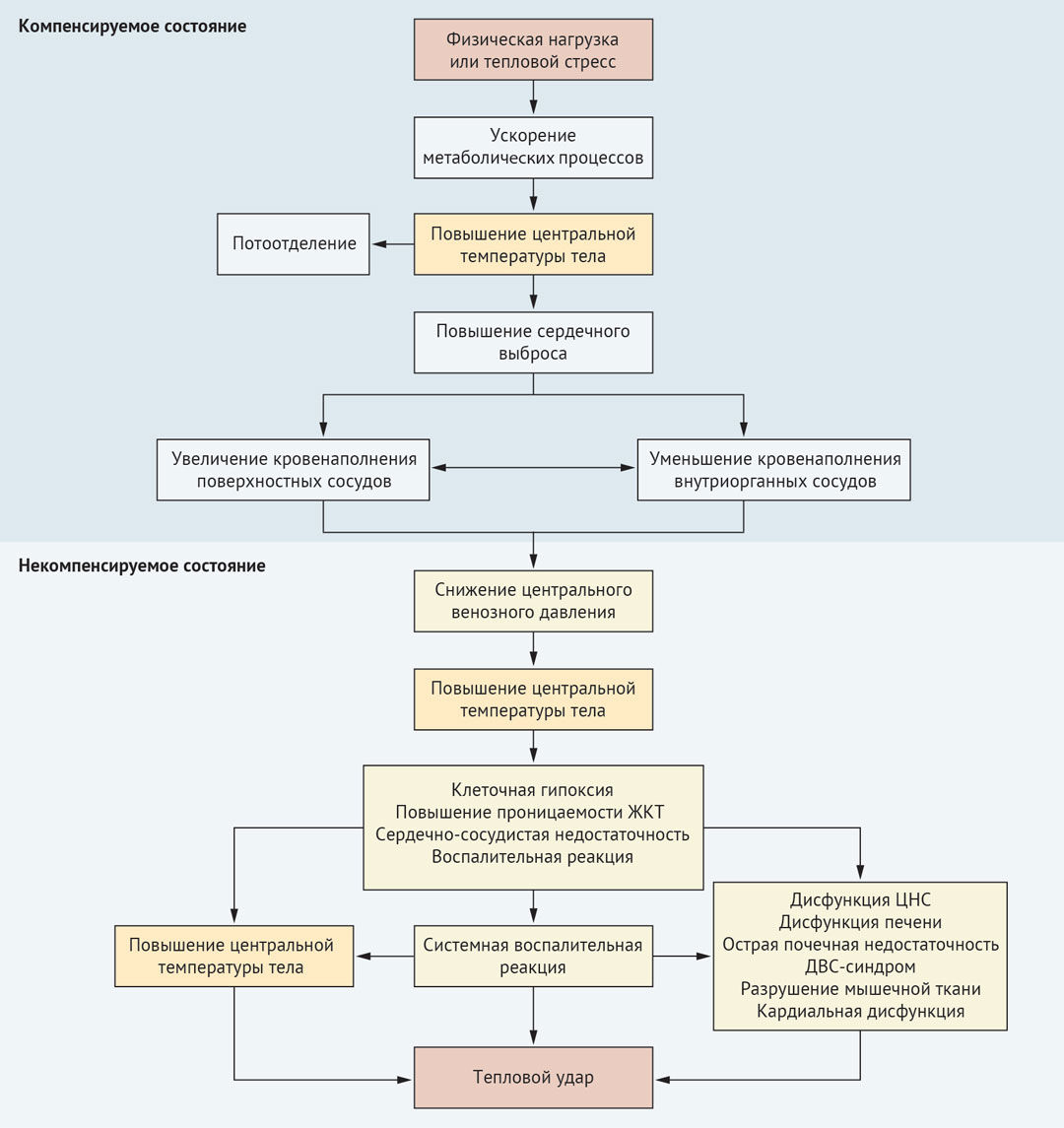
Гипертермия, вызванная пассивным воздействием тепла, способствует попаданию эндотоксина слизистой оболочки кишечника и интерлейкинов 1 и 6 из мышц в циркулирующую кровь, что индуцирует избыточную активацию лейкоцитов и эндотелиальных клеток, и высвобождение цитокинов, в том числе белка HMGB1 (high-mobility group protein B1), который секретируется активированными макрофагами и моноцитами. Так же, как ядерный белок, HMGB1 высвобождается при некрозе клеток и тканей, после чего связывается с рецептором врожденного иммунитета TLR4 (толл-подобный рецептор 4), что приводит к секреции цитокинов макрофагами и синдрому системного воспалительного ответа. Воспалительные и коагуляционные реакции и прямое цитотоксическое действие тепла повреждают эндотелий сосудов, что приводит к микротромбозам. Из-за микротромбоза, вторичного снижения количества тромбоцитов и вызванной гипертермией агрегации тромбоцитов их количество уменьшается. Тепловой удар также подавляет высвобождение тромбоцитов из костного мозга из-за чувствительности мегакариоцитов к воздействию высоких температур. Клинически это проявляется активацией коагуляции, вызванной тепловым ударом, и образованием фибрина.
Лечение
Быстрое и эффективное охлаждение является краеугольным камнем лечения, поэтому его следует откладывать только для проведения сердечно-легочной реанимации (СЛР). При отсутствии определенной конечной температуры целевая температура для безопасного прекращения охлаждения составляет 39°C (лучше 38,5–38,0°C), чтобы снизить риск последствий. При тепловом ударе, обусловленном физической нагрузкой, скорость охлаждения, превышающая 0,10°C в минуту, является безопасной и желательной для улучшения прогноза. Погружение в холодную воду при тепловом ударе, обусловленном физической нагрузкой, является приемлемым методом для достижения скорости охлаждения от 0,20 до 0,35°C в минуту. В полевых условиях, когда лед недоступен, скорость охлаждения приблизительно 0,10°C в минуту может быть достигнута путем обливания большим количеством воды и обеспечения циркуляции свежего воздуха. У пожилых людей с классическим тепловым ударом погружение в холодную воду может наладить приемлемую скорость охлаждения, но тактика лечения включает использование одного или нескольких типов кондуктивного или испарительного охлаждения, таких как инфузия холодных жидкостей (внутрисосудистый контроль температуры), прикладывание пакетов со льдом или влажных марлевых салфеток, проветривание помещения. Данные методы не самые эффективные, но лучше переносятся пожилыми людьми, легко доступны и применимы во время жаркого сезона, когда отделения неотложной помощи переполнены пациентами.
Фармакологические препараты не ускоряют процесс охлаждения. Жаропонижающие, такие как аспирин и ацетаминофен, неэффективны при тепловом ударе, поскольку лихорадка и гипертермия повышают температуру тела через различные патофизиологические пути. Кроме того, жаропонижающие средства усиливают коагулопатию и дисфункцию печени у пациентов с тепловым ударом. Антагонист рецепторов рианодина дантролен, используемый при лечении злокачественной гипертермии, проходит клинические испытания в отношении терапии теплового удара, но в настоящее время нет доказательств его эффективности.
Первая помощь при тепловом ударе на догоспитальном этапе
В случае необходимости СЛР действовать согласно протоколу интенсивной терапии по поддержанию сердечной деятельности на догоспитальном этапе (ACLS protocol), обеспечить оксигенацию 4 л/мин, чтобы поднять уровень сатурации до >90 %. Охлаждение: при тепловом ударе, обусловленном физической нагрузкой, — погружение в холодную воду; при классическом тепловом ударе — кондуктивное или испарительное охлаждение. Ввести изотонический солевой раствор (1−2 л/час), хотя обезвоживание не является главной проблемой. При судорогах: бензодиазепины (5 мг) до прекращения судорог (не более 20 мг). При классическом тепловом ударе немедленно транспортировать пациента в пункт оказания неотложной помощи, при тепловом ударе, обусловленном физической нагрузкой, — транспортировать после снижения температуры до < 39.0°C.
В пункте оказания неотложной помощи
Необходим мониторинг ректальной или интравезикальной температуры и обеспечение снижения центральной температуры тела < 38,0°C, для этого использовать охлаждающую жидкость (4°C, 1000 мл/30 мин) путем инфузии через центральный катетер. При судорогах: ввести бензодиазепины (5 мг) или фенитоин (ударная доза — 15–20 мг/кг в течение 15 минут) до прекращения судорог. Лабораторный контроль: общий анализ крови и мочи, посев крови, мониторинг функции почек и печени (АЛТ, АСТ, аммиак, международный нормализационный индекс), анализ на уровень глюкозы и электролитов, газы артериальной крови и кислотно-щелочное равновесие, креатинкиназу, ЛДГ, миоглобин, С-реактивный белок, также коагулограмма. Повторять каждые 12 часов в течение первых 48 часов, затем каждые 24 часа. Обеспечить мониторинг гемодинамики: при недостаточности кровообращения необходимо ввести жидкость (30 мл/кг), учитывать сердечно-сосудистые заболевания и осуществлять инвазивный гемодинамический мониторинг, поддерживать среднее артериальное давление на уровне > 65 мм рт. ст. (или > 75 мм рт. ст. у пожилых или гипертоников). Все это необходимо, чтобы нормализовать уровень молочной кислоты и диурез (> 50 мл/кг/час), можно применять вазопрессоры в случае неудачной терапии.
Лечение дисфукции органов в ОРИТ
Быстрая диагностика и эффективное охлаждение в большинстве случаев устраняют дисфункцию органов. Тем не менее охлаждения может быть недостаточно для полного восстановления. Своевременное применение адъювантной терапии может иметь решающее значение. Стандартом медицинской помощи является симптоматическое поддержание функций органов и учет возможности развития синдрома системного воспалительного ответа.
При сердечной недостаточности: в случае необходимости выполнить СЛР в соответствии с протоколом ACLS, обеспечить инвазивный гемодинамический мониторинг, сделать эхокардиографию. При легкой полиорганной недостаточности назначают добутамин (1 мкг/кг/мин, затем 2–20 мкг/кг/мин при необходимости) или милринон (ударная доза — 50 мкг/кг, затем 0,2–0,75 мкг/кг/мин) и адреналин (1 мкг/мин); при тяжелой полиорганной недостаточности возможна экстракорпоральная мембранная оксигенация.
При острой почечной недостаточности показано введение кристаллоидного раствора для обеспечения диуреза > 50 мл/кг/час, введение фуросемида (10–20 мг у пациентов без предварительного воздействия диуретиками, последующая доза зависит от количества мочи). При тяжелом ацидозе, гиперкалиемии или уремии обеспечить гемодиализ или продолжительную вено-венозную гемофильтрацию, отрегулировать скорость инфузии жидкости в соответствии с артериальным давлением и объемом мочи, контролировать электролиты и корректировать при необходимости.
При энцефалопатии и отеке мозга <8 по шкале комы Глазго интубировать и провести механическую вентиляцию. Для легкой гипервентиляции (PСО2 — 34–36 мм рт. ст.) вводят гипертонический солевой раствор (3 %) внутривенно (начальная доза — 100 мл/30 мин, затем в зависимости от общего количества воды в организме пациента для повышения уровня натрия на 12 ммоль/день) или маннит 20 % (0,25–2 г/кг за 30 мин). Необходимо держать голову пациента под углом 45 градусов, вводить транквилизаторы. Пациентам с гипераммониемией требуется гемофильтрация или применение системы рециркуляции молекулярного адсорбента. Мониторинг внутричерепного давления.
При остром некрозе скелетных мышц: инфузия жидкости 1–2 литра/час, затем 300 мл/час; фуросемид (10–20 мг у пациентов без предшествующего диуретического лечения, последующая доза зависит от количества мочи), в случае перегрузки жидкостью — бикарбонат натрия 30 ммоль/час (для достижения рН мочи > 6,5). Учитывать возможность миоглобинурии, избегать гиперкальциемии и метаболического алкалоза (рН > 7,5).
При ДВС-синдроме и других патологиях коагуляции: при кровотечении и тромбозе вводят свежезамороженную плазму (болюсная доза 10–15 мл/кг, затем 200–400 мл в соответствии с показателями коагуляции). Вводить криопреципитат (5–10 ед. каждый раз) для уровня фибриногена < 180 мг/дл и концентраты тромбоцитов (инфузия одной терапевтической дозы), если количество тромбоцитов < 20 на мм3 или если имеется кровотечение и количество тромбоцитов < 50 на мм3. У пациентов с печеночной недостаточностью считают критическую концентрацию клеточной популяции для достижения целевого международного нормализованного индекса ≤ 1,5, избегать применение гепарина, развития гипотермии и метаболического ацидоза.
При остром респираторном дистресс-синдроме: провести интубацию и механическую вентиляцию, избегать перегрузки жидкостью. При дисфункции печени: контролировать функцию печени и психическое состояние в течение не менее 4 дней. Обеспечить поддерживающее лечение: гемодинамическая стабильность, N-ацетилцистеин (начальная доза — 50 мг/кг в 200 мл 5 % раствора глюкозы болюсно в течение 20 минут, затем 50 мг/кг в 500 мл 5 % раствора глюкозы в течение 4 часов, затем 100 мг/кг в 1000 мл 5 % раствора глюкозы в течение 16 часов). Ввести гипертонический раствор 3 % или маннитол (0,25–2 г/кг в 30 мин в 20 % растворе), гемофильтрация, слабительные (например, оральная лактулоза, 30 мл каждые 2 часа до возникновения диареи), пероральный рифаксимин (400 мг 3 раза в день) при развитии спонтанной печеночной недостаточности; пересадка печени редко требуется, и нет никаких доказательств ее эффективности.
Непрерывный мониторинг ЭКГ на предмет возможных аритмий. Изменения на ЭКГ неспецифичны. При синдроме системной воспалительной реакции: лечить так же, как сепсис, рассмотреть применение антибиотиков.
Профилактика
Профилактика теплового удара более эффективна, чем лечение, и, безусловно, проще. Во время жары важно помнить о мерах снижения риска классического теплового удара. Эти меры включают акклиматизацию к изменившимся условиям окружающей среды, избегание тренировок в условиях жары. Не стоит носить одежду, которая препятствует испарению пота. Людям с ранними признаками болезни не следует активно заниматься физическими упражнениями. Важно знать о побочных эффектах лекарств, которые могут вызвать потерю жидкости, снижение потоотделения или снижение частоты сердечных сокращений. Не оставлять без присмотра взрослых или детей в автомобиле.
Источники:
- Hifumi T. et al. Heat stroke //Journal of intensive care. – 2018. – Т. 6. – №. 1. – С. 30.
- Epstein Y., Yanovich R. Heatstroke // New England Journal of Medicine. - 2019. - T. 380. - №25 - С. 2449-2459.
- Oliver Andrews, Corinne Le Quéré, Tord Kjellstrom, Bruno Lemke, Andy Haines. Implications for workability and survivability in populations exposed to extreme heat under climate change: a modelling study // The Lancet Planetary Health. - 2018. - T. 2. №. 12. - С. e540-e547.
- John E. Hall. Guyton and Hall Textbook of Medical Physiology. - 2018. - C. 1328.
