Захватнические войны рака поджелудочной железы
Рак поджелудочной железы известен своим агрессивным течением и высокой летальностью, например, в США пятилетняя выживаемость после постановки диагноза составляет только 8 %. На момент выставления диагноза злокачественная опухоль обычно уже имеет отдаленные метастазы, чаще всего — в печень. Это крайне затрудняет дальнейшее лечение и обрекает на неудачу попытки радикальных вмешательств [1].
Печень печально известна как излюбленный орган для формирования отдаленных метастазов. Такой метастатический тропизм обусловлен в значительной мере механическим улавливанием циркулирующих опухолевых клеток. Но метастазирование — сложный процесс, в котором задействовано множество сигнальных путей, каждому из которых принадлежит определенная роль. Опухолевые клетки из первичного очага должны не только покинуть «родное гнездо», но и обустроить новое. Для этого в органе-мишени должна быть подготовлена прометастатическая ниша с локальными клеткам, перепрограммированными на ее поддержание и обеспечение.
Злокачественно трансформированные клетки поджелудочной железы рекрутируют различные молекулы для своей новой резиденции у гепатоцитов, задействуя своих собственных «эйчаров» в микроокружении первичной опухоли. Среди них — неатипичные фибробласты, уже на этапе раннего онкогенеза секретирующие белок интерлейкин 6 (ИЛ-6), являющийся цитокином (рис. 1). ИЛ-6 связывается со своим рецепторным белком на гепатоцитах и активирует экспрессию сигнального преобразователя и активатора транскрипции 3 (STAT3) путем фосфорилирования (добавление фосфатной группы). Клетки печени, которые экспрессируют такой активированный STAT3, в свою очередь секретируют сывороточные белки амилоида типа А (SAA1 и SAA2). Эти молекулы рекрутируют миелоидные клетки, обеспечивающие ингибирование противоопухолевых Т-лимфоцитов и снижение локального иммунного ответа [2].
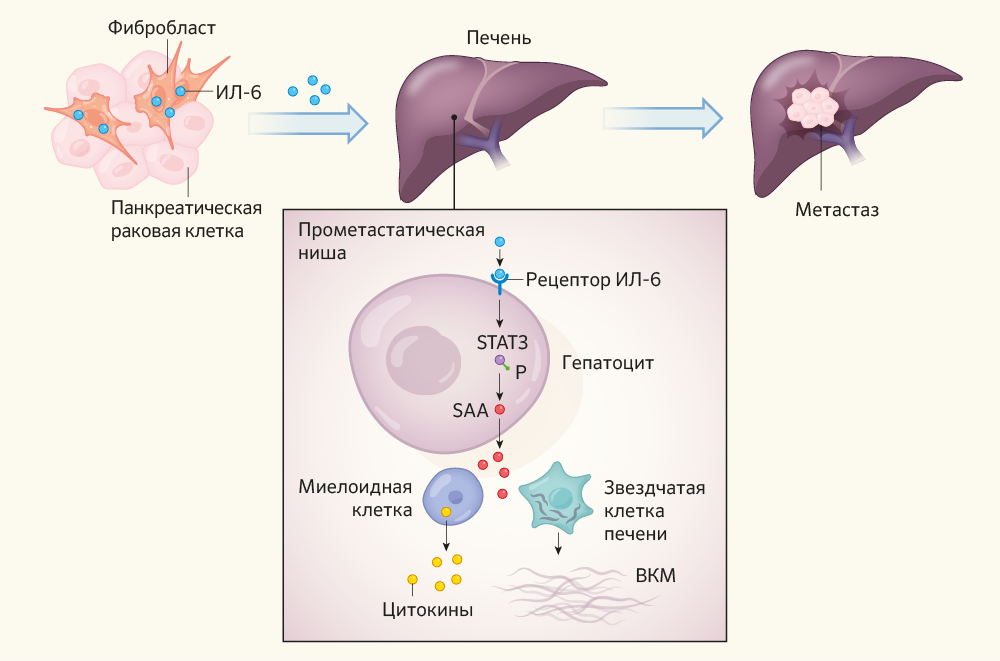
Рисунок 1 | Сигнальные пути метастатического поражения печени при раке поджелудочной железы.
ИЛ-6, который синтезируется в нормальных, неатипичных фибробластах, расположенных в опухолевом микроокружении, является ключевым фактором инвазии печени. ИЛ-6 по кровеносной системе достигает печени, где связывается со своим рецептором на клетках ее паренхимы. В результате фосфорилируется белок STAT3 — сигнальный преобразователь/трансдуктор и активатор транскрипции 3 (на рисунке: P обозначает фосфатную группу), что повышает экспрессию белков семейства сывороточного амилоида А (SAA1 и SAA2). Данный процесс рекрутирует миелоидные клетки, которые экспрессируют молекулы цитокинов, ослабляющие локальный иммунный ответ. Белки семейства SAA также активируют звездчатые клетки печени, которые продуцируют материал внеклеточного матрикса (ВКМ). Эти изменения создают благоприятную для опухолевых клеток среду, называемую прометастатической нишей. Теперь раковые клетки поджелудочной железы могут проникать в печень и образовывать и далее поддерживать метастатические очаги [2].
SAA1 и SAA2 также управляют активацией звездчатых клеток печени (клетки Ито, перисинусоидальные липоциты, жиронакапливающие клетки печени, стеллатные клетки), локализующихся в пространствах Диссе между гепатоцитами и эндотелиальной выстилкой синусоидов. Эта популяция клеток рассматривается как возможные региональные стволовые клетки печени, так как они экспрессируют один из маркеров кроветворных мезенхимальных стволовых клеток — CD133. В покоящемся состоянии они отличаются крупными цитоплазматическими липидными каплями, содержащими витамин А [3].
Активация приводит к усилению экспрессии десмина и трансдифференцировке с приобретением миофибробластоподобного фенотипа. В активированном состоянии наблюдается прогрессирующее уменьшение числа липидных капель в цитоплазме, вплоть до полного исчезновения. Миофибробластоподобная дифференцировка обуславливает экспрессию гладкомышечного альфа-актина и продукцию компонентов внеклеточного матрикса (коллагены I, III, V типов), которые запускают процесс фиброзирования. Это способствует первоначальному закреплению и поддержанию дальнейшей жизнедеятельности метастатических раковых клеток. Также при развитии фиброза формируется гипоксия печеночной ткани, что приводит к избыточной экспрессии провоспалительных хемоаттрактантов (моноцитарных, нейтрофильных), стимулирующих образование провоспалительных цитокинов. Воспаление поддерживает индукцию активации звездчатых клеток, что еще больше усугубляет фиброз. В итоге формируется порочный круг: активация звездчатых клеток белками SAA — фиброз — воспаление — цитокиновая активация звездчатых клеток [4].
При блокировании сигнальных компонентов прометастатической ниши (ИЛ-6 фибробластов, STAT3, SAA1 или SAA2-клеток паренхимы печени) метастатическая нагрузка (количество и размеры метастатических очагов в печени) на клеточных культурах-моделях рака поджелудочной железы была существенно снижена, по сравнению с контрольной группой. При этом отмечались метастазы в легкие, сходные в обеих группах, что подтверждает идею о специфичности печеночного метастатического паттерна.
Изучается роль других возможных структур «метастатического авангарда» рака поджелудочной железы. Например, в экзосомах, секретируемых первичными раковыми клетками, при их транспортировке в печень отмечен высокий уровень экспрессии фактора, ингибирующего миграцию макрофагов (MIF). Он нивелировал фиброз-опосредованное привлечение клеток макрофагального ряда, что позволило инициировать образование прометастатической ниши. Обнаружено, что ИЛ-6-опосредованная передача сигналов не влияет на уровни MIF, что позволяет предположить, что эти две системы, предназначенные для управления образованием прометастатических ниш, взаимозаменяемы. Вероятно, метастазирование имеет как основные, так и резервные механизмы [5].
Ввиду раннего метастазирования терапевтическая тактика должна строиться с учетом метастатических каскадов. Обсуждается эффективность таргетной терапии против образования метастатической ниши: использование ингибиторов STAT3 или антител, которые блокируют связывание ИЛ-6 с его рецептором.
Источники:
1. McGuigan A. et al. Pancreatic cancer: A review of clinical diagnosis, epidemiology, treatment and outcomes. World journal of gastroenterology.2018;24,43: 4846-4861.
2. Lee J.W. et al. Hepatocytes direct the formation of a pro-metastatic niche in the liver. Nature.2019;567:249–252.
3. Costa-Silva B.et al. Pancreatic cancer exosomes initiate pre-metastatic niche formation in the liver. Nat Cell Biol. 2015;17(6):816-26.
4. Peinado H. et al. Pre-metastatic niches: organ-specific homes for metastases. Nature Reviews Cancer.2017; 17.5: 302.
5. Groot, Vincent P. et al. Patterns, timing, and predictors of recurrence following pancreatectomy for pancreatic ductal adenocarcinoma. Annals of surgery 2018; 267.5:936-945.
