Железная смерть для мезотелиомы
Мезотелиома — крайне агрессивный тип злокачественной опухоли. Источник — мезотелиальные клетки. Одним из важнейших этиологических факторов мезотелиомы является воздействие асбеста, также упоминается влияние биологических факторов (полиомавирус Simian vacuolating virus или SV-40) и генетической предрасположенности.
Один из наиболее распространенных инактивированных онкосупрессоров в таких опухолях — белок мерлин (кодируется геном Neurofibromatosis 2, NF2), который отвечает за взаимодействие актиновых компонентов цитоскелета и клеточной мембраны. Мерлин является компонентом высококонсервативного сигнального пути Hippo, где он участвует в контроле пролиферации за счет контактного торможения роста клеток. Хорошо изучена роль этого сигнального каскада в регулировании пролиферации клеток нейроэктодермального происхождения. С мутациями в гене NF2 ассоциировано развитие нейрофиброматоза II типа. При повреждении гена NF2 и прекращении синтеза мерлина инициируется опухолевый рост в центральной нервной системе и по ходу периферических нервов с образованием опухолей различных гистотипов, прежде всего шванном и менингиом.
Супрессорная активность мерлина проявляется при дефосфорилировании серина на С-конце молекулы. При инактивации мерлина, а также серин-треониновой протеинкиназы LATS2 (Large Tumor Suppressor 2) активируются белки YAP (Yes-ассоциированный белок) и TAZ (транскрипционный коактиватор с PDZ-связывающим мотивом), которые взаимодействуют с транскрипционными факторами и регулируют ядерную экспрессию генов.
При нормально функционирующих мерлине, LATS2 и LATS1 белки YAP и TAZ подвергаются фосфорилированию, что блокирует их функцию, предотвращая проникновение в ядро. При снижении экспрессии гена NF2 наблюдается увеличение числа дефектных кадгериновых клеточных контактов, так как мерлин связывается с Е-кадгерин-β-катениновым комплексом [1].
Wu и коллеги сообщают, что высокая экспрессия E-кадгерина в клетках мезотелиомы человека, выращенных in vitro, связана с устойчивостью к ферроптозу [2].
Гибель клеток, происходящая в результате ферроптоза, зависит от реакции между ионами железом и перекисью водорода. Ионы кислорода или свободные радикалы также способны окислять фосфолипиды, но не приводят к данному типу регулируемой клеточной гибели. Во время ферроптоза полиненасыщенные жирные кислоты в клеточной мембране подвергаются перекисному окислению, что вызывает повышение агрессивных активных форм кислорода. Данная реакция протекает значительно быстрее в присутствии двухвалентного железа. В итоге образующиеся радикалы запускают автокаталитическую цепь самоокисления липидов. В клетке имеется механизм антиоксидантной защиты — фермент глутатионпероксидаза 4, способный восстановить опасные высокореактивные гидроперекиси липидов (LOOH) в нетоксичные спирты (LOH), и субстрат этого фермента — трипептид глутатион. Ключевой органеллой ферроптоза является эндоплазматический ретикулум, в котором развивается стрессовая реакция (стресс эндоплазматического ретикулума). Ее ключевой момент — нарушение правильного фолдинга белков, ввиду чего они не могут переместиться в цитоплазму и заполняют эндоплазматический ретикулум с последующей агрегацией [3].
Ферроптоз часто связан с истощением аминокислоты цистеина, которая транспортируется в клетки белком SLC7A11 (член семейства белков Solute Carrier 7, подтип 11). В дальнейшем цистеин участвует в биосинтезе глутатиона, обеспечивающего защиту от окислительного стресса [4].
Обнаружено, что обработка сорафенибом культур клеток мезотелиомы с мутациями в гене, кодирующем белок мерлин, заставляет клетки подвергаться ферроптозу. Это возможно за счет ингибирования сорафенибом SLC7A11. В итоге глутатион не образуется, и клетки с YAP- и TAZ-опосредованной экспрессией генов становятся беззащитны перед ферроптозом (рис. 1) [5]. Кроме сорафениба, известны и другие молекулы, блокирующие транспорт цистеина (эрастин и имидазолкетонэрастин, сульфасалазин) [4].
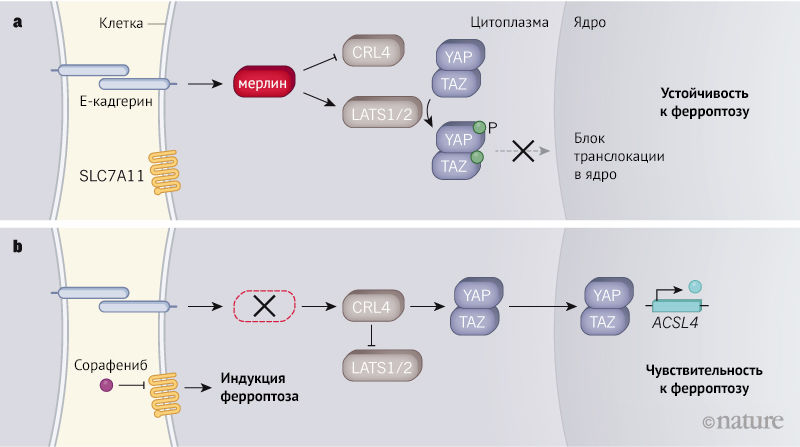
b — При отсутствии экспрессии мерлина CRL4 не ингибируется, LATS1 и LATS2 не могут функционировать, YAP и TAZ проникают в ядро и активируют экспрессию генов, в том числе и ген, кодирующий белок 4 семейства ацил-КоА-синтетаз длинной цепи (ACSL4), который способствует ферроптозу. То есть опухолевые клетки, в которых нарушен синтез мерлина, при лечении ингибитором SLC7A11 сорафенибом могут подвергаться ферроптозу [5].
Идентификация мезотелиом с инактивированным сигнальным путем Hippo может стать успешной стратегией для разработки персонализированной терапии. Однако, кроме мерлина, в этом сигнальном каскаде важную роль играют белки LATS1 и LATS2, и их значение для канцерогенеза еще предстоит выяснить. Ключевые белки феррочувствительности опухолевых клеток — YAP и TAZ — регулируют транскрипцию около 22 генов, которые могут стать диагностической панелью для выявления чувствительных к ферроптозу опухолей.
Источники:
- Wang Y., Yu L., Ding J., Chen Y. Iron Metabolism in Cancer. Int J Mol Sci. 2018;20(1):95
- Wu J. et al.Intercellular interaction dictates cancer cell ferroptosis via NF2-YAP signalling. Nature. 2019. [Epub ahead of print]
- El Hout M., Dos Santos L., Hamaï A., Mehrpour M. A promising new approach to cancer therapy: Targeting iron metabolism in cancer stem cells. Semin Cancer Biol. 2018 Dec;53:125-138.
- Papa S. et al. Phase 2 study of sorafenib in malignant mesothelioma previously treated with platinum-containing chemotherapy. J Thorac Oncol. 2013;8(6):783-7.
- Fennell D.Cancer-cell death ironed out. Nature. 2019[Epub ahead of print].
