Клиническая химия: аминокислоты и белки

Этот пост придется по нраву всем тем, кто сейчас сидит, свесив голову над толстым учебником Е. С. Северина (или аналогичным), а также тем, кто неравнодушен к биохимии.
Мало какие аминокислоты интересуют врача в повседневной практике. В основном методы их определения используются при подозрении на врожденную патологию обмена аминокислот. Тут всем на ум должна была прийти фенилкетонурия. А кому не пришла на ум: возможно, стоит таки не закрывать учебник Северина.
Для освежения памяти: фенилаланин-4-гидроксилаза катализирует превращение фенилаланина в тирозин. При недостаточности этого фермента фенилаланин окисляется до фенилпировиноградной и фенилмолочной кислот, оказывающих токсическое действие на организм. Второй важной аминокислотой, а точнее ее производным является гомоцистеин, который часто повышается при развитии сердечно-сосудистых заболеваний и при тромбообразовании. Аминокислоты также часто становятся объектом клинических исследований. Существенно значимым является увеличение их концентрации вдвое выше нормы. При ФКУ или лейцинозе (болезнь «кленового сиропа») характерны показатели, превышающие норму в 10–20 раз.
В случае аминокислот исследованию подвергается плазма или сыворотка крови (хранится при комнатной температуре сутки или в холодильнике максимально неделю) или же суточная моча (хранится охлажденной или при помощи консерванта тимола в изопропаноле). При скрининге новорожденных используют тест Гатри, который по сути представляет собой ни что иное как картон, смачиваемый каплями крови тестируемого.

Существуют и более дорогие методы скрининга: тандемная масс-спектрометрия для диагностики нарушений обмена аминокислот и карнитина, ионообменная хроматография (с помощью которой возможно разделить аминокислоты, после чего их смешивают с нингидрином и определяют фотометрически), а также многочисленные молекулярно-генетические методы.
Физиологическая норма отличается в каждом отдельном случае в зависимости от метода измерения, возраста и питания пациента. Также стоит учитывать, что с течением времени в пробе наблюдается снижение концентрации глутамина и аспарагина, а содержание глутаминовой и аспарагиновой кислот, напротив, увеличивается. Об этом стоит помнить при длительной транспортировке крови до лаборатории.
О функциях различных белков можно говорить часами и долго читать толстые главы в учебниках. Остановимся сначала на общих аспектах.
Самым старым методом выявления протеинов является метод Кьельдаля. Он основан на реакциях окисления пробы с последующим выделением аммиака с помощью дистилляции и его титрованием. Как вы уже догадываетесь, рассчитанное значение не будет специфичным: в крови помимо аминокислот находится много других соединений, содержащих азот, например, (как минимум) мочевина и мочевая кислота. Поэтому перед обработкой необходимо выделить все протеины из плазмы.
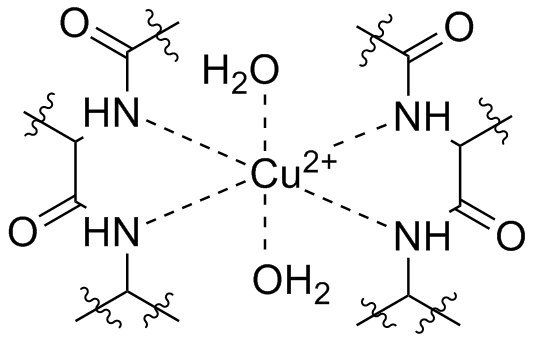
В настоящее время чаще используют биуретовый метод: ионы меди связывают (согласно различным источникам) четыре или шесть атомов азота, в результате чего в щелочной среде образовываются красно-фиолетовые комплексы, которые возможно фотометрически детектировать при длине волны 546 нм. Тартрат, содержащийся в смеси для исследования, образует комплекс с ионами меди, который в щелочной среде возможно осадить в виде нерастворимого гидроксида меди. Йодид, также добавляемый в пробу, предупреждает восстановление меди. Интенсивность цвета пропорциональна количеству пептидных связей. Таким образом, с помощью метода невозможно установить структуру белка, но можно определить его общую концентрацию.
Если же белка в материале недостаточно для исследования вышеуказанным методом, прибегают к методу Лоури, при котором используют фосфомолибдат/фосфовольфрамат.
Также при проведении биуретовой пробы невозможно определить количество белка в спинномозговой жидкости и моче. В этом случае обычно сперва осаждают белки с помощью трихлоруксусной кислоты, центрифугируют их, а затем с помощью гидроксида натрия снова переводят в раствор. Также к пробам с малым содержанием протеинов часто добавляют пигменты, связывающие их в кислой среде. Например, пирогаллол красный, молибдат или кумасси бриллиантовый синий.
Не нужно специальных знаний, чтобы представить себе причины нарушения концентрации белков: как и в случае любой концентрации, тут может измениться или количество вещества в растворителе, или же растворителя станет больше или меньше, что тоже изменит концентрацию. Чтобы определить, какие именно белки повлияли на это значение, устанавливают, во-первых, показатель гематокрита, а во-вторых, проводят электрофорез сыворотки крови. Для этого на анализ берут сыворотку или плазму крови. Следует учитывать, что концентрация протеинов также зависит от положения тела и длительности венозного застоя во время взятия пробы. Эти два фактора вызывают отклонения на 10 % от истинного значения.
Биуретовый метод очень чувствителен к нескольким факторам: если в крови содержится большое количество жиров или проба по другим причинам является мутной (например, после введения растворов декстрана), то результаты исследования могут оказаться завышенными. В некоторых инфузионных растворах содержатся протеины (дериваты желатина). Сорбит и маннит, высокие концентрации глюкозы и фруктозы могут привести к завышенным результатам теста. Гемолиз и высокие концентрации билирубина в плазме крови также могут влиять на результаты теста.
Общее количество белка в крови у новорожденных в норме составляет 46–68 г/л, у детей старшего возраста 60–80 г/л, а у взрослых 66–83 г/л. Чаще всего причиной изменения концентрации белков (за исключением случаев дегидратации, гипергидратации и потери протеинов в результате кровотечения или нарушений всасывания) является уменьшение содержания альбуминов или же повышение количества иммуноглобулинов.
Гипопротеинемия может быть следствием врожденных (анальбуминемия) или же приобретенных нарушений (нарушение синтеза альбумина в результате поражений печени (гепатит, некроз клеток печени), нарушения всасывания (например, при цистическом фиброзе), а также при недостаточном потреблении белка (алиментарный маразм, квашиоркор)). Снижение концентрации альбумина может также быть следствием нефротического синдрома и гломерулонефрита (потеря альбумина через почки), экссудативной энтеропатии (язвенный колит, болезнь Крона), потери альбумина после ожогов через кожу или же после пункции асцита или жидкости из плевральной полости.
Псевдогипопротеинемию наблюдают при повышении количества жидкости в организме в результате инфузионной терапии, при потере крови, а также во время беременности.
Гиперпротеинемия часто является следствием повышения фракции гамма-протеинов в сыворотке крови. Причиной также может быть моноклональная гаммапатия, при которой концентрация протеинов может достигать 140 г/л. Псевдогиперпротеинемия наступает при потере большого количества жидкости вследствие эксикоза (жажда, diabetes insipidus или при сильном поносе).
Для проведения электрофореза используют сыворотку или плазму крови. В последнем случае в пробу дополнительно добавляют тромбин, а также отделяют пробу от фибриногена. Также с помощью этого метода возможно исследование мочи.
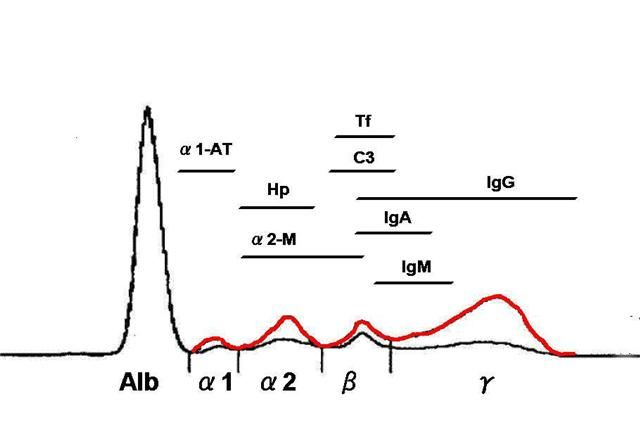
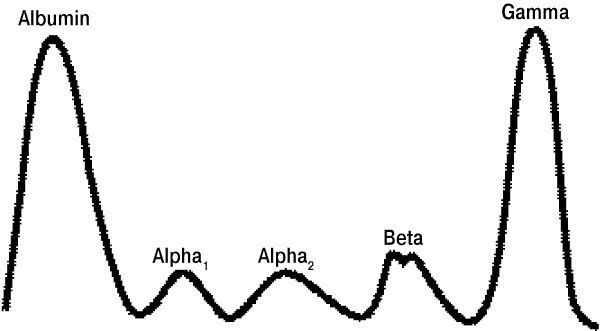
Каждая фракция глобулинов содержит множество протеинов, выполняющих разные функции, поэтому для определения конкретного нарушения всегда требуются дополнительные иммунологические тесты.
Для интерпретации анализов белков плазмы крови необходимо знать функции отдельных ее составляющих. В зависимости от молекулярной массы и заряда молекул, для каждой группы протеинов плазмы характерен определенный характер движения в электрическом поле при электрофорезе в геле. В зависимости от этого различают несколько групп белков:
- Преальбумин (транстиретин) — участвует в связывании тироксина, трийодтиронина и ретинол-связывающего белка;
- Альбумины — поддерживают онкотическое давление крови, осуществляют транспорт ионов, билирубина, гормонов, лекарственных средств;
- К фракции α1-глобулинов относятся транскортин (отвечает за синтез кортизола), альфа-1-кислый гликопротеин (орозомукоид), ингибиторы протеаз (альфа-1-антитрипсин, антихимотрипсин);
- На границе между α1 и α2-глобулинами обычно располагаются тироксин-связывающий глобулин и интер-альфа-ингибитор трипсина;
- К α2 фракции глобулинов относят участвующий в синтезе гемоглобина гаптоглобин, ретинол-связывающий белок, альфа-2-микроглобулин, антитромбин III, псевдохолинэстеразу, С1-ингибитор, альфа-2-антиплазмин;
- К фазе бета-глобулинов относят трансферрин, бета2-гликопротеин 1, С-реактивный белок, гемопексин, плазминоген;
- На границе гамма-фазы располагаются иммуноглобулин А, бета-2-микроглобулин, С3-компонент комплемента;
- Гамма-фракцию составляют исключительно иммуноглобулины (G, M, D, E).
Обычно электрофорез выглядит так, как мы его и привыкли видеть, однако при некоторых заболеваниях именно этот метод анализа помогает выявить, какая из фракций плазмы крови представлена в нехарактерном для нее количестве. Моноклональные гаммапатии встречаются при плазмоцитоме, болезни Вальденстрема, а также при увеличении концентрации тяжелых цепей иммуноглобулинов в плазме крови. Увеличение белков α1- и α2-фракций характерно для острых воспалительных процессов, снижение доли альбумина в крови при одновременном увеличении α2-и β-фракций может быть свидетельством нефротического синдрома. Увеличение белков γ-фракции при одновременном снижении концентрации альбумина встречается при циррозе печени. Равномерное уменьшение содержания всех белков фракции иммуноглобулинов свидетельствует о недостаточности синтеза антител. Если при анализе ошибочно использовалась цельная плазма крови, а не ее сыворотка, то полученные результаты можно спутать с таковыми при моноклональной гаммапатии.
Классическим примером заболевания, диагностика которого проводится посредством электрофореза белков крови, является талассемия. При этой патологии нарушается синтез глобиновых цепей, что приводит к гипохромной микроцитарной анемии. В мазке крови наблюдаются характерные для этого заболевания мишеневидные эритроциты. Хронический гемолиз приводит к гемосидерозу тканей с вторичным поражением органов и нарушением их функций (сердце, печень, поджелудочная железа, почки). Из-за хронически сниженной концентрации гемоглобина организм постоянно испытывает гипоксию, что приводит к замедлению процессов роста тканей и ломкости костей вследствие разрастания костного мозга. При тяжелых формах талассемии также наблюдается спленомегалия.
При бета-талассемии из-за сниженного синтеза β-цепей глобина компенсаторно увеличивается синтез γ- и δ-цепей, фетального гемоглобина (HbF > 2 %) и HbA2 (> 3 %). α-цепи образуют агрегаты, что в процессе созревания эритроцитов приводит к их гемолизу, делая процесс гемопоэза неэффективным. При анемии Кули (большая форма талассемии с полным отсутствием β-цепей) анемия развивается уже в детском возрасте: наблюдается гиперплазия костного мозга, что заметно по внешнему вида ребенка из-за неравномерно развитых костей, спленомегалия и гемосидероз. При промежуточной форме талассемии (синтез β-цепей сильно снижен) анемия протекает более мягко — рост детей в норме, иногда наблюдается желтуха. Симптомами обычно являются спленомегалия, выпирание нижней челюсти, образование камней в желчных протоках, сердечная недостаточность из-за гемосидероза. При малой форме (синтез β-цепей снижен незначительно) многие пациенты не жалуются на вышеупомянутые симптомы, однако часто у них наблюдается анемия легкой степени тяжести.
При альфа-талассемии снижается синтез α-цепей глобина. Компенсаторно увеличивается синтез β-цепей, из-за чего образуется тетрамерный гемоглобин H (HbH), наличие которого позволяет идентифицировать поврежденные клетки в мазке крови с помощью специальных методов окрашивания препарата. Пренатально увеличивается синтез γ-цепей. В отличие от бета-талассемии, в данном случае постановка диагноза на основе электрофореза невозможна, поскольку соотношение HbF к HbA2 остается нормальным. HbH не влияет на электрофорез, но усиливает гемолиз за счет повреждения мембраны эритроцитов. Тяжесть заболевания зависит от того, сколько альфа-цепей повреждено. Повреждение всех четырех цепей несовместимо с жизнью, только лишь одной — клинически не выявляется, а HbH клетки при этом отсутствуют вовсе.
Помимо талассемии, существует несколько других заболеваний, возникающих, когда трансляционный аппарат дает сбой. Примером мутаций митохондриальных генов, кодирующих транспортные РНК, являются мутации, приводящие к митохондриальным энцефаломиопатиям (синдром MELAS).
К самым распространенным приобретенным нарушениям транскрипции и трансляции относят недостаточную продукцию аминокислот при недоедании или нарушениях всасывания (квашиоркор, маразм). Такие нарушения синтеза белков и аминокислот видны на клеточном уровне: эндоплазматический ретикулум и аппарат Гольджи фрагментируются, существенно снижается количество рибосом. Эти изменения часто приводят к недостаточности гормонов щитовидной железы (гипотиреоз) и гормонов роста (при недостаточности передней доли гипофиза).
К посттрансляционным нарушениям относятся нарушения гидроксилирования, гликозилирования, карбоксилирования и ацетилирования белков. Нарушения этих процессов приводят к таким патологиям, как, например, CDG-синдром (congenital disorder of glycosylation — врожденное нарушение гликозилирования) и синдром Элерса — Данлоса VI типа. Примерами приобретенных синдромов, связанных с подобного рода нарушениями, служит недостаточность витаминов К и С. Недостаточный посттрансляционный протеолиз белков также может приводить к нарушениям синтеза коллагена (синдром Элерса — Данлоса VII типа).
В обычном случае после всех этих модификаций протеины запасаются в клетке или транспортируются с целью последующего высвобождения. Специальные белки-шапероны участвуют в разрушении неправильно сформированных белков. К примеру, при недостаточности альфа-1-антитрипсина причиной этому является мутация в гене, представленном в нескольких вариантах. Его М-форма (генотип PIMM, где PI — ингибитор протеазы) считается нормой. Вариант Z (PIZM или PIZZ) встречается при замене лишь одной аминокислоты в позиции 342 этого гена (вместо глутамата — лизин). Это приводит к изменению конформации альфа-1-антитрипсина, который больше не высвобождается из клетки, а накапливается в ней. Из-за нарушения ингибирования секреторных протеаз (например, эластазы) происходит протеолиз нормальных тканей и, как следствие, цирроз печени или легочная эмфизема.
Системы утилизации протеинов, такие как катепсиновая и убиквитиновая, регулируются гормонально. Инсулин, анаболические стероиды, факторы роста и незаменимые аминокислоты тормозят распад белков. Глюкагон, кортикостероиды, катехоламины и цитокины (например, фактор некроза опухоли-альфа), наоборот, стимулируют их деструкцию. Усиленный распад белков наблюдается при многих патологических состояниях, например, при сепсисе, ожогах, травмах, уремии, ацидозе, инсулинзависимом диабете. Все эти факторы стимулируют убиквитинирование протеинов и их распад с участием протеасом. Этот процесс регулируется при помощи активации факторов транскрипции, таких как, например, транскрипционный фактор NF-κB, влияющий на транскрипцию белков протеасом.
Источники:
- Dörner K. Klinische Chemie und Hämatologie: 69 Tabellen;[Taschenlehrbuch]. – Georg Thieme Verlag, 2009.
- Renz H. (ed.). Praktische Labordiagnostik: Lehrbuch zur Laboratoriumsmedizin, klinischen Chemie und Hämatologie. – Walter de Gruyter, 2014.
