Фактор XX: половые различия иммунного ответа
Кроме социально-экономических и поведенческих факторов, а также различий в образе жизни, биологический пол также является важными эпидемиологическим фактором, влияющим на частоту и тяжесть инфекционных заболеваний. Явный половой диморфизм бактериальных инфекций регистрируется как у людей, так и на животных моделях (см. табл.) [1].
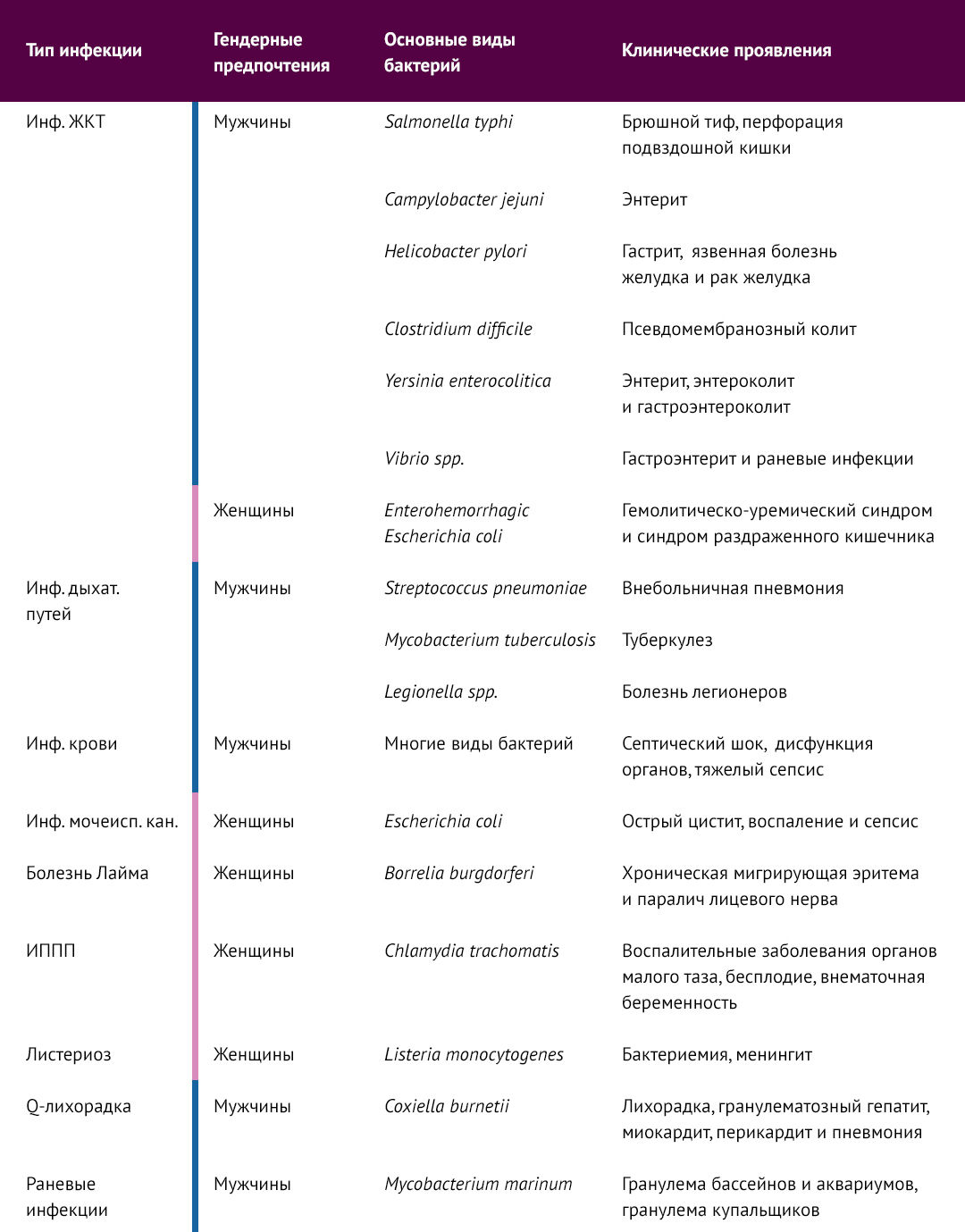
В целом, мужчины (здесь и далее — генотипически мужчины XY) более восприимчивы к желудочно-кишечным, респираторным бактериальным инфекциям и сепсису, в то время как женщины (здесь и далее — генотипически женщины XX) более восприимчивы к бактериальным инфекциям мочеполовой системы.
При повреждении желудочно-кишечного тракта мужчины продуцируют преимущественно провоспалительные цитокины, такие как IL-6 и TNF-α, женщины — противовоспалительные факторы (IL-10), защитные факторы эндотелия, отмечается также повышение уровня оксида азота (NO) [2]. В итоге воспалительный ответ у мужчин приводит к некрозу клеток и последующей перфорации органов.
Также наблюдается различный иммунный ответ на сепсис, который характеризуется специфическим профилем про- и противовоспалительных цитокинов. В частности, пациенты мужского пола демонстрируют более высокие уровни провоспалительных цитокинов, таких как IL-6 и TNF-α, а также повышенные уровни маркеров бактериемии (прокальцитонин), чем женщины. Напротив, у пациентов женского пола высок уровень противовоспалительного цитокина IL-10. Эти различия между иммунными реакциями позволяют предположить, что у женщин проявляется ранний и контролируемый провоспалительный ответ, который предотвращает инфекцию, а за ним следует противовоспалительный ответ, что в итоге позволяет избежать системного повреждения. У мужчин же наблюдается поздний и стойкий активный провоспалительный ответ, приводящий к системному повреждению [3]. Таким образом, при острых воспалительных процессах, таких как сепсис или ожоговая болезнь, у женщин наблюдается тенденция к лучшему клиническому течению и увеличению выживаемости, по сравнению с мужчинами. При этом женщины имеют худший прогноз течения хронических воспалительных заболеваний, таких как астма, тяжелая форма хронической обструктивной болезни легких (ХОБЛ), муковисцидоз и серповидно-клеточная анемия [2].
Длительное время главное значение придавалось гормональным факторам. Предполагается, что защита женщин от бактериальных инфекций и связанных с ними осложнений обусловлена провоспалительным эффектом эстрадиола, в то время как восприимчивость мужчин к этим инфекциям связана с иммуносупрессией, опосредованной тестостероном, вероятно, через их специфические рецепторы. Недавние исследования показывают, что защитный эффект эстрадиола зависит от подтипа рецептора эстрогена и конкретного тканевого компартмента, участвующего в бактериальном поражении. Можно предположить, что тканеспецифическая экспрессия определенных половых стероидных рецепторов обусловливает уникальную восприимчивость к бактериальным инфекциям [4]. Тем не менее уровни половых гормонов очень низкие до наступления половой зрелости, и недавние исследования показали значительные различия в иммунных маркерах у мальчиков и девочек, не достигших пубертата, страдающих от острых или хронических воспалительных заболеваний [5].
В настоящий момент в фокусе внимания также и генетические факторы. Большое количество генов, связанных с иммунными функциями, расположено в Х-хромосоме. Женщины (ХХ) наследуют две естественно полиморфные родительские Х-хромосомы, тогда как мужчины (XY) наследуют только материнскую Х-хромосому. Следовательно, женщины несут полиморфные Х-связанные аллели от обоих родителей, в то время как мужчины несут только материнские варианты. Чтобы исключить двойную дозу экспрессии генов у женщин, в клетках происходит случайный выбор единственной активной Х-хромосомы, а вторая подвергается инактивации во время раннего эмбрионального развития. Этот процесс включает метилирование одной из X-хромосом, что делает ее неактивной. Хотя клетки сохраняют и копируют неактивную ДНК во время клеточных делений, блок экспрессии сохраняется в течение всей жизни клетки. В итоге формируется мозаичный организм, приблизительно в половине клеток которого активна отцовская Х-хромосома, а в другой половине экспрессируются гены материнской Х-хромосомы (рис. 1) [6].
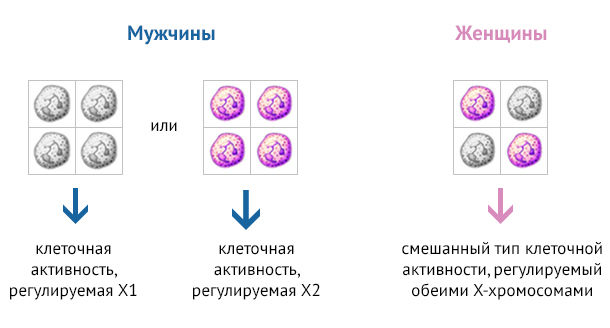
Рисунок 1 |X-связанный мозаицизм приводит к разнообразию фенотипов у женщин, обеспечивая гибкость в условиях динамически изменяющегося патофизиологического состояния. Это контрастирует с мужчинами, у которых единственная материнская X-хромосома (Х1 или Х2 на рисунке) определяет экспрессию ассоциированных с ней генов.
Это обеспечивает программу высокополиморфной экспрессии X-сцепленных генов, в том числе и определяющих иммунологические процессы, таких как гены, кодирующие Toll-подобные рецепторы (TLR-7 и 8), рецепторы цитокинов, факторы транскрипции и белки, которые участвуют в активности Т и В-клеток [4].
Воспаление часто считают обоюдоострым мечом, потому что оно необходимо для контроля и уничтожения чужеродных микроорганизмов, однако избыточный воспалительный ответ может привести к дисфункции органов, септическому шоку и даже смерти. Расширение представлений о многообразии факторов иммунного ответа может способствовать развитию новых терапевтических стратегий.
Источники:
1. Vazquez-Martínez E.R. et al. Sexual dimorphism in bacterial infections. Biol Sex Differ. 2018; 9(1):27.
2. Klein S.L., Flanagan K.L. Sex differences in immune responses. Nat Rev Immunol. 2016;16:626–638. doi: 10.1038/nri.2016.90.
3. Chowdhury F.R., Nur Z., Hassan N., von Seidlein L., Dunachie S. Pandemics, pathogenicity and changing molecular epidemiology of cholera in the era of global warming. Ann Clin Microbiol Antimicrob. 2017;16:10.
4. Lefevre N.et al. The Number of X Chromosomes Influences Inflammatory Cytokine Production Following Toll-Like Receptor Stimulation. Front Immunol. 2019;10:1052.
5. Casimir G.J. et al. Gender differences in inflammatory markers in children. Shock. 2010;33(3):258-62.
6. Chamekh M., Casimir G. Editorial: Sexual Dimorphism of the Immune Inflammatory Response in Infectious and Non-infectious Diseases. Front Immunol. 2019;10:107.
