«Филадельфийская хромосома» и ее продукты: влияние реципрокной транслокации на развитие некоторых видов гемобластозов
Одними из наиболее агрессивных злокачественных новообразований человека были и остаются гемобластозы — опухоли кроветворной ткани. Своеобразным и наиболее изученным маркером некоторых гемобластозов, а чаще всего хронического миелоидного лейкоза, является «филадельфийская хромосома» — продукт реципрокной транслокации участков хромосом, происходящей без потери генетического материала и с образованием химерных белковых продуктов. В этом материале расскажем о происхождении известной многим «филадельфийской хромосомы» и других транслокаций, приводящих к формированию неопластических процессов в красном костном мозге.
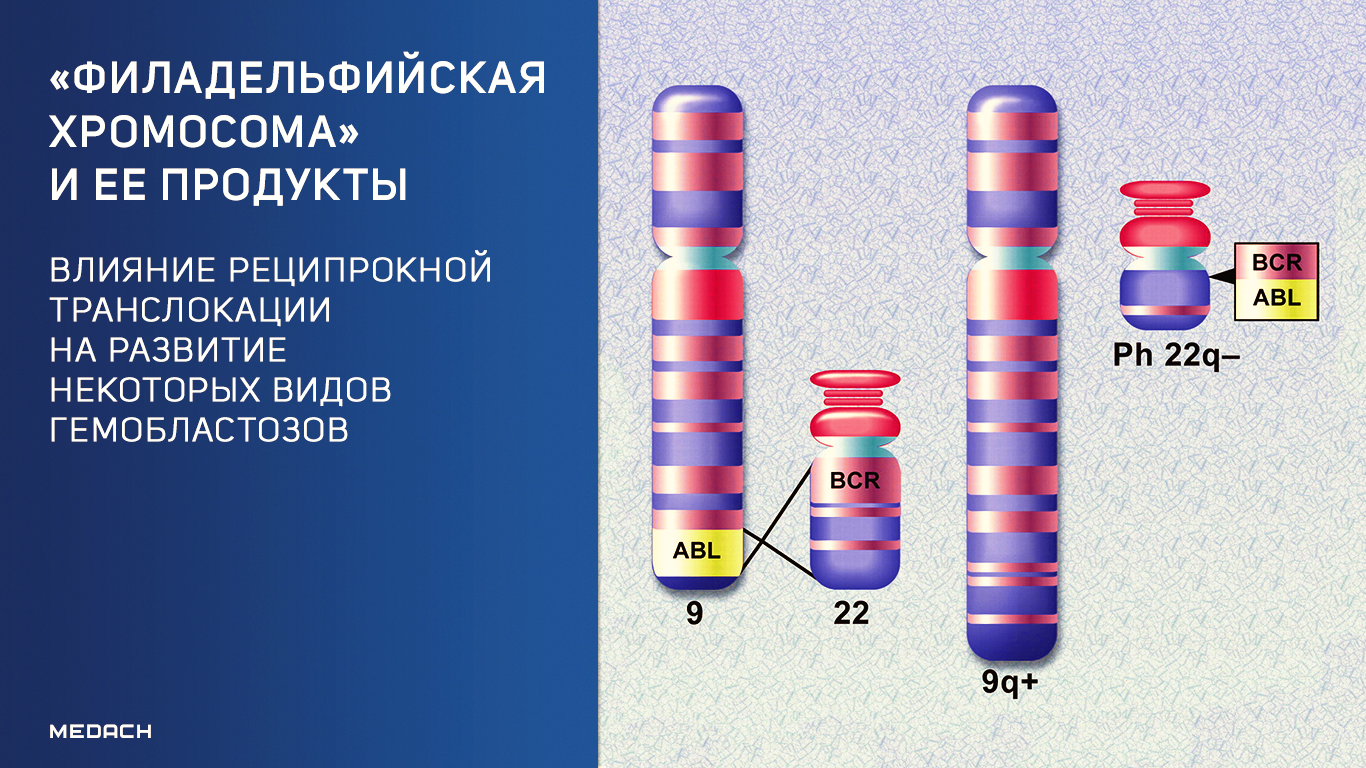
«Филадельфийская хромосома» — это результат транслокации участков 9 и 22 хромосом, не приводящей к потере генетического материала. Вариант такой хромосомной перестройки был открыт в 1960 году в ходе изучения этиологии множества случаев хронического миелоидного лейкоза (ХМЛ). Ассоциированные с данной транслокацией гемобластозы (95 % от общего числа) стали обозначаться как Ph+, но важность открытия заключается не столько в обнаружении собственно транслокации. Функциональная активность данной хромосомной перестройки обусловливается слиянием участков нормальных генов с формированием химерных генов и их белковых продуктов.
Наиболее часто слиянию с другими генами подвергается ген BCR. Причины этого пока не ясны, однако предполагается, что это связано с локализацией BCR в нестабильном участке 9 хромосомы. Этот участок наиболее часто подвергается поломкам в метафазе ввиду репликативного стресса, и транслокация является одним из вариантов такой поломки. Хотя слияние BCR с другими генами было обнаружено и в солидных опухолях внутренних органов, функционально активные химерные белки — продукты слившихся генов — отмечаются исключительно в различных вариантах гемобластозов [1].
Наиболее часто в ткани красного костного мозга при гемобластозах обнаруживается функционально активный химерный белок BCR/ABL — продукт слияния генов BCR и ABL1. Ген BCR/ABL1 включает в себя участки обоих слившихся генов-партнеров в разных вариантах. Наиболее распространенным, особенно среди случаев хронического миелоидного лейкоза, является вариант p210 — слияние экзонов 13 и 14 от BCR с экзоном 1 от ABL. Каждый из структурных вариантов белка BCR/ABL активирует различные сигнальные пути, которые при этом могут иметь только внутриклеточную локализацию (в связи с цитоплазматической локализацией химерных белков). Так, вариант p210 стойко ассоциирован с активацией киназ STAT5 и MAPK [2].
Активация этих и других сигнальных путей ведет к повышению выживаемости опухолевой клетки и скорости ее пролиферации, что обеспечивает агрессивный характер ассоциированных гемобластозов. Наиболее часто химерные гены, образованные в результате слияния BCR, обнаруживаются при хроническом миелоидном лейкозе, остром лимфобластном лейкозе, остром миелобластном лейкозе, истинной полицитемии [1].
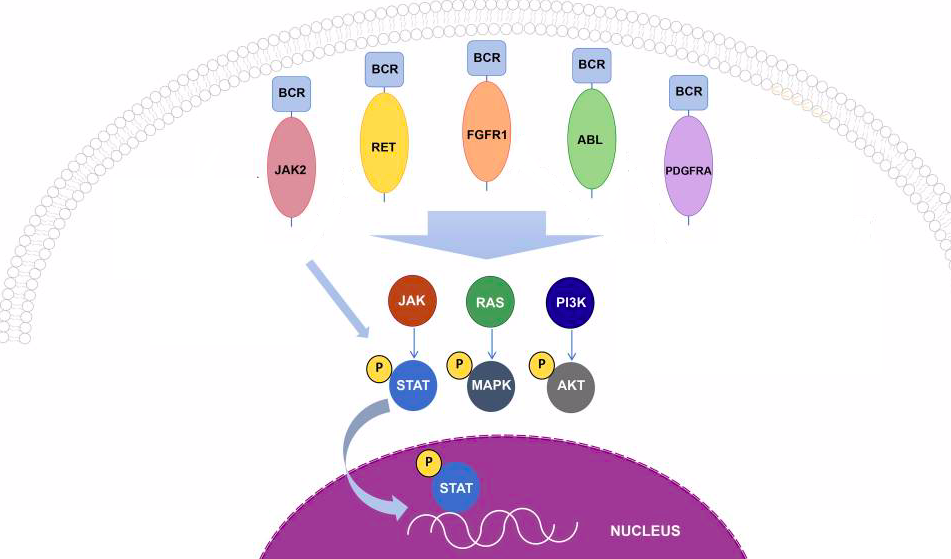
Рисунок 1 | Каскады киназ, ассоциированные с различными слияниями гена BCR.
Интересно, что любой из структурных вариантов гена BCR/ABL1 предполагает расположение BCR в качестве N-концевого участка и ABL — как С-концевого участка. Все варианты химерных генов также включают домен спиральной катушки с участками BCR и функционально активный домен с участками ABL. Предполагается, что домен спиральной катушки от BCR вызывает димеризацию ABL, что модулирует его функциональную активность — именно поэтому лечение Ph+ хронического миелоидного лейкоза основано на ингибировании функции ABL [1].
Встречаются и варианты слияния BCR с другими генами. Реже, чем в случае «филадельфийской хромосомы», BCR обнаруживается в ассоциации с FGFR1, PDGFRA, RET и JAK2. Такие транслокации встречаются при различных гемобластозах относительно редко, но клинические данные свидетельствуют о том, что пациенты, несущие данные мутации, должны получать дополнительную персонализированную таргетную терапию. Важным способом определения этой и других транслокаций, ассоциированных с развитием гемобластозов, стали различные методы секвенирования (о них мы писали в этом материале — https://medach.pro/post/1858). К настоящему моменту определено более 500 онкогенных транслокаций, благодаря чему стала возможна по-настоящему персонализированная медицина ассоциированных с ними клинических состояний.
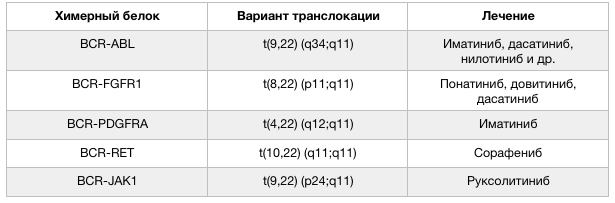
Рисунок 2 | Варианты транслокации с участием гена BCR и лечение гемобластозов, ассоциированных с такими транслокациями [1].
Открытие химерного белка BCR/ABL позволило предложить новые методы лечения пациентов с гемобластозами, в первую очередь — с хроническим миелоидным лейкозом и острым лимфобластным лейкозом. В типичных случаях для лечения ХМЛ использовали интерферон альфа, гидроксикарбамид и бусульфан, однако применение этих препаратов не позволяло добиться полного цитогенетического ответа. В 1996 году был разработан иматиниб — ингибитор ABL, используемый для лечения Ph+ ХМЛ. Его внедрение в клиническую практику привело к существенному удлинению ремиссий хронического миелоидного лейкоза и позволило чаще добиваться значительного гематологического и цитогенетического ответа у большинства пациентов. Вслед за этим последовало открытие ингибиторов тирозинкиназ второго и третьего поколений: к ним относятся такие препараты, как дазатиниб, нилотиниб, босутиниб. Внедрение данных средств позволило увеличить ожидаемую продолжительность жизни пациентов с хроническим миелоидным лейкозом на 3–7 лет [3].
Использование иматиниба и других ингибиторов тирозинкиназ вскоре стало сопровождаться формированием лекарственной резистентности. Наиболее часто такая резистентность связана с формированием мутации T315I. Данная мутация ассоциирована со снижением аффинитета киназных ингибиторов и способна восстанавливать утраченный лейкемогенный потенциал BCR/ABL. Пациентам, несущим такую мутацию, мало помогает таргетная терапия ингибиторами тирозинкиназ, поэтому в настоящее время ведется активный поиск средств, способных обходить действие T315I [4].
Одним из препаратов, обладающих таким потенциалом, является таксодион, полученный из хвойного растения — болотного кипариса (Taxodium distichum). В экспериментах этот препарат в значительной степени индуцирует апоптоз ассоциированных с миелогенными лейкемиями клеток, положительных в отношении гена BCR/ABL. Такcодион снижает активность III митохондриального комплекса дыхательной цепи, что приводит к выработке активных форм кислорода, накопление которых ведет к индукции гибели опухолевых клеток. Таким образом, таксодион имеет большой потенциал как противоопухолевое средство с высокой эффективностью в отношении клеток с BCR/ABL, которое способно функционировать при наличии мутации T315I [5].
Таким образом, «филадельфийская хромосома» раскрывается для нас с новой стороны: становятся известны причины формирования дефекта и следствия его наличия. На сегодняшний день научный поиск в отношении BCR/ABL и других транслокаций значительно продвинулся, что отразилось на продолжительности и качестве жизни пациентов с гемобластозами, однако нельзя заявлять, что патогенез этих злокачественных новообразований полностью изучен. По-прежнему требуются исследования и разработки, способные нивелировать все современные проблемы фармакорезистентности, а возможно и повысить эффективность лечения различных форм гемобластозов.
Источники:
1. BCR: a promiscuous fusion partner in hematopoietic disorders. / Malalage N. Peiris, Fangda Li, Daniel J. Donoghue. // Oncotarget. - 2019. - Vol. 10, №28. - p. 2738-2754.
2. Association of BCR/ABL transcript variants with different blood parameters and demographic features in Iraqi chronic myeloid leukemia patients. / Khazaal MS, Hamdan FB, Al-Mayah QS. // Mol Genet Genomic Med. - 2019. - e.809.
3. The molecular mechanisms underlying BCR/ABL degradation in chronic myeloid leukemia cells promoted by Beclin1-mediated autophagy. / Xianbo Huang, Ying Li, Lihong Shou [et al]. // Cancer Manag Res. - 2019. - Vol. 11. - p. 5197-5208.
4. The gatekeeper mutation T315I confers resistance against small molecules by increasing or restoring the ABL-kinase activity accompanied by aberrant transphosphorylation of endogenous BCR, even in loss-of-function mutants of BCR-ABL. / Mian AA, Schull M, Zhao Z [et al]. // Leukemia. - 2009. - Vol. 23, №9. - p. 1614-1621.
5. The mechanisms of taxodione-induced apoptosis in BCR-ABL-positive leukemia cells. / Uchihara Y, Tago K, Funakoshi-Tago M. // Nihon Yakurigaku Zasshi. - 2019. - Vol. 153, №4. - p. 147-154.
