«Идущие на смерть»: обзор механизмов регулируемой клеточной гибели

Клеточная смерть — это необратимая дегенерация жизненно важных клеточных функций (синтез АТФ и поддержание окислительно-восстановительного гомеостаза), приводящая к потере целостности клетки (нарушение проницаемости цитоплазматической мембраны или фрагментация клетки). Данный процесс отличен от клеточного старения — необратимой потери пролиферативного потенциала, связанной с определенными морфологическими и биохимическими признаками, что сопровождается секрецией множества факторов (то есть клетка приобретает так называемый секреторный фенотип, ассоциированный со старением — SASP); при этом клеточное старение не является формой гибели клеток.
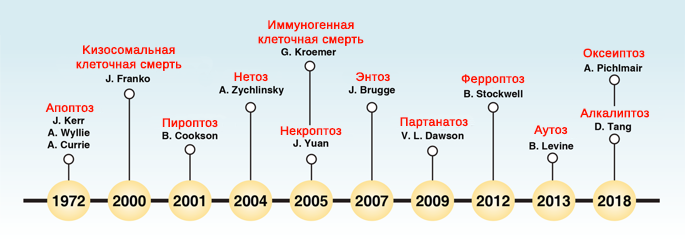
Рис.1. Хронология терминов, используемых в исследовании клеточной смерти [1].
Современная система классификации гибели клеток была обновлена Комитетом номенклатуры по гибели клеток (Nomenclature Committee on Cell Death, NCCD) в 2018 году, с учетом данных многолетней истории изучения этого загадочного процесса (рис. 1) [1]. Помимо фундаментального деления на случайную (accidental cell death, ACD) и регулируемую (regulated cell death, RCD) клеточную смерть, в последней дополнительно выделено несколько подпрограмм, имеющих как четкое физиологическое значение (например, некроптоз и пироптоз, которые наблюдаются во время эмбрионального развития и при вирусных инфекциях), так и представленные клеточными реакциями на специфические токсины (ферроптоз, энтоз, нетоз, партанатоз, зависимая от лизосом и аутофагии гибель клеток, а также недавно описанные формы гибели клеток, вызываемые изменением pH среды (алкалиптоз) и активными формами кислорода, без вовлечения уже известных механизмов (оксеиптоз)). Регуляция гибели клеток проявляется в том, что конкретные генетические или фармакологически-индуцированные изменения способны как запустить, так и прервать деструкцию клеток [2].
Интересно, что регулируемая гибель клеток не является уникальной для многоклеточных форм жизни, где она имеет ключевую роль в поддержании гомеостаза организма как в физиологических, так и в патологических условиях, но также встречается (в упрощенном варианте) среди одноклеточных эукариот, образующих (по крайней мере, в течение части их жизненного цикла) колонии (несколько видов дрожжей и Dictyostelium discoideum), апоптозоподобный вариант клеточной гибели описан у организмов Leishmania spp. и даже у некоторых прокариот (например, Escherichia coli) [3].
Гибель клеток проявляется морфологическими изменениями. Вместе с механизмами утилизации мертвых клеток и их фрагментов такие морфотипы используются для классификации гибели клеток на три различные формы: (1) гибель клеток I типа или апоптоз, проявляющийся конденсацией цитоплазмы, конденсацией хроматина (пикноз), фрагментацией ядра (кариорексис) и блеббингом («пузырение») цитоплазматической мембраны с сохранением ее целостности вплоть до финальных процессов; кульминацией является образование интактных мелких пузырьков (апоптотических телец), которые эффективно захватываются соседними клетками с фагоцитарной активностью (путем эффероцитоза) и разрушаются внутри лизосом; (2) гибель клеток II типа или аутофагия, проявляющиеся обширной цитоплазматической вакуолизацией и, сходным образом заканчивающиеся фагоцитарным поглощением и последующей лизосомальной деградацией, и (3) гибель клеток III типа или некроз (рис. 2) [2].
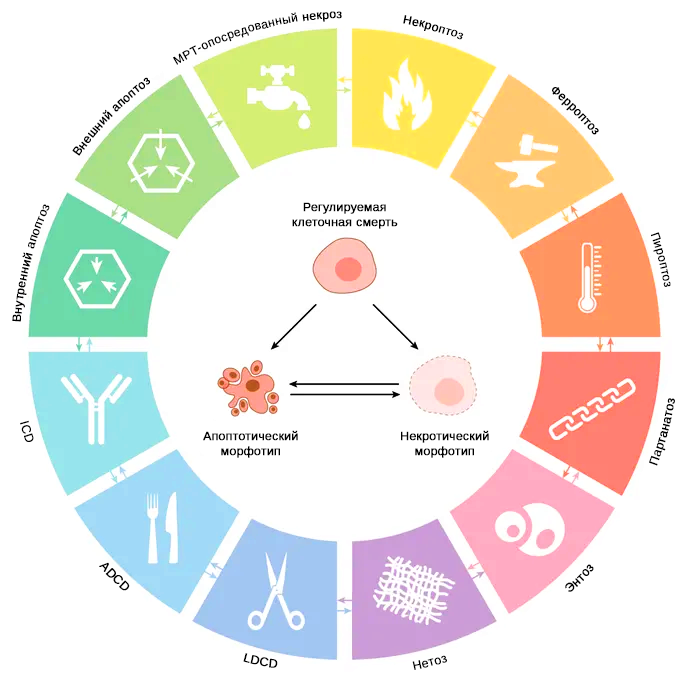
Рис. 2. Основные подпрограммы регулируемой клеточной смерти | Клетки, подвергающиеся нерепарируемым нарушениям внутриклеточной или внеклеточной микросреды могут активировать один из многих каскадов сигнальной трансдукции, что в конечном итоге приводит к их гибели. Каждый из таких режимов регулируемой гибели клеток инициируется и осуществляется молекулярными механизмами. Морфологические признаки вариабельны: от полностью некротического морфотипа до полностью апоптотического; иммуномодулирующее действие также различно: от противовоспалительного и толерогенного до провоспалительного и иммуногенного [2].
КС ПМП-клеточная смерть, регулируемая переходом митохондриальный проницаемости, осуществляется за счет формирования одноименной поры (также называемой мегапорой), в образовании и дальнейшем поддержании которой играет важную роль циклофилин D (CypD / пептидилпрол-цис-транс-изомераза F) на фоне снижения АТФ и повышения уровня кальция в клетке [5]. Сокращения: РКС-регулируемая клеточная смерть; АЗКС-аутофагия-зависимая клеточная смерть; ЛЗКС-лизома-зависимая клеточная смерть; ИКС - иммуногенная клеточная смерть.
В классификации сформулированы определения различных программ клеточной смерти.
Случайная гибель клеток — фактически мгновенная и неконтролируемая (собственно умирающей клеткой) форма гибели клеток, морфологически соответствующая деструкции и фрагментации компонентов цитоплазматической мембраны, вызванная экстремальными физическими, химическими или механическими воздействиями.
Регулируемая гибель клеток — форма гибели клеток, которая возникает в результате активации одного или нескольких модулей сигнальной трансдукции и, следовательно, может быть фармакологически или генетически смодулирована. Субпрограммы регулируемой гибели клеток описаны в табл. 1 [1, 2, 4].
Таблица 1
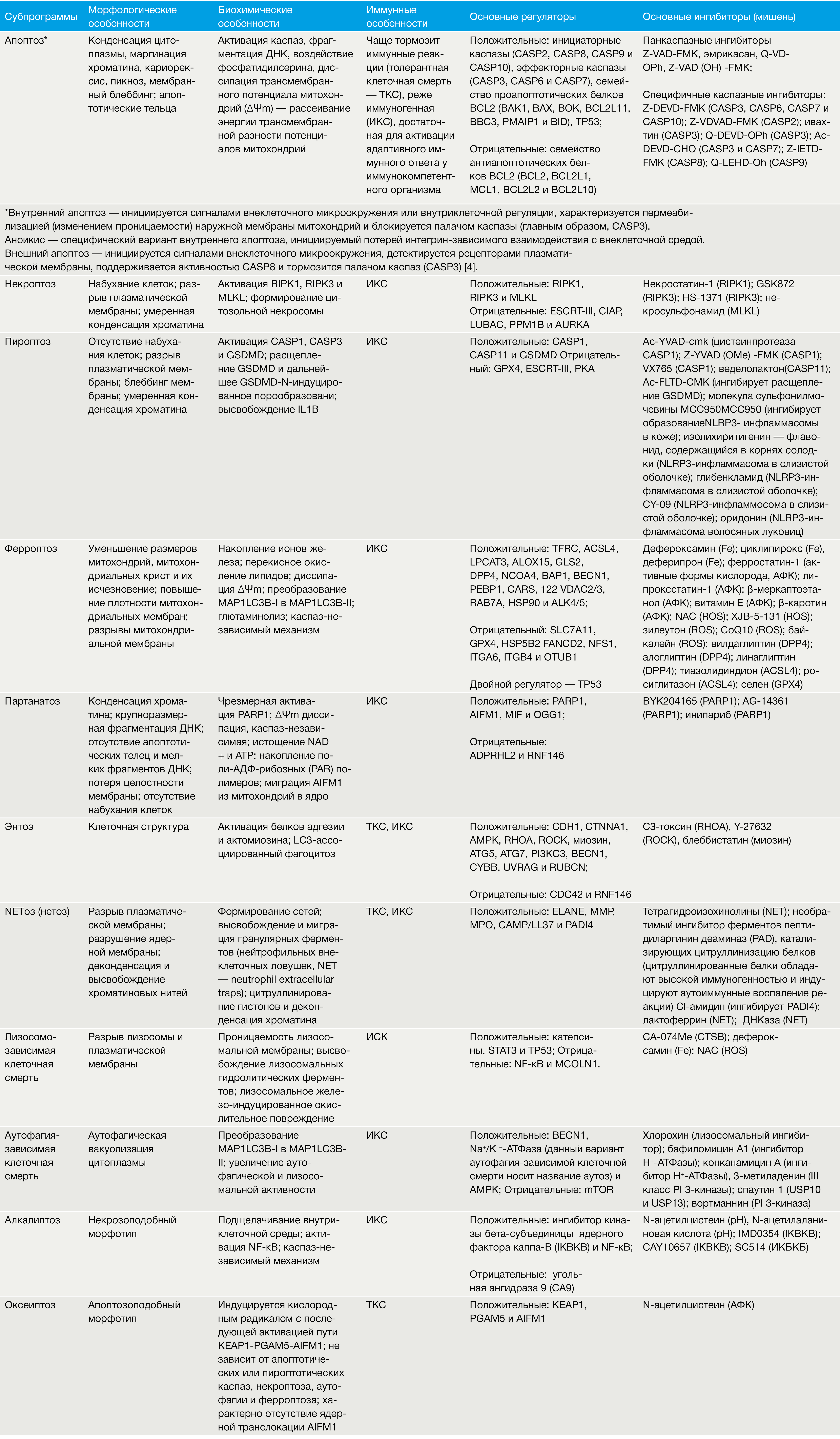
Регулируемая гибель клеток включает в себя множество субпрограмм, выполнение которых приводит к различным морфологическим изменениям и иммунологическим последствиям. Механизмы клеточной смерти могут встречаться в «чистой» форме или в смешанных вариантах, в которых появляются различные летальные субпрограммы, действующие параллельно, а иногда и по типу иерархического каскада.
Список литературы:
1. Tang D, Kang R, Berghe TV, Vandenabeele P, Kroemer G. The molecular machinery
of regulated cell death. Cell Res. 2019 (5):347-364.
2. Galluzzi L. et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death Differ. 2018 (25): 486–541.
3. Pandey S. S., Singh S., Pathak C., Tiwari B. S. Programmed Cell Death: A Process of Death for Survival - How Far Terminology Pertinent for Cell Death in Unicellular Organisms. Journal of cell death. 2018 (11): 1179066018790259.
4. Singh, R., Letai, A., Sarosiek, K. Regulation of apoptosis in health and disease: the balancing act of BCL-2 family proteins. Nat. Rev. Mol. Cell Biol. 2019 (20): 175–193.
5. Fayaz S.M., Raj Y.V., Krishnamurthy R.G. CypD: The Key to the Death Door. CNS Neurol Disord Drug Targets. 2015; 14 (5):654-63.
