По ту сторону выживания

Противоопухолевая терапия не только лечит, но и наносит ущерб организмам детей. По мере того, как все больше детей переживают эту болезнь, ученые направляют силы на поиск возможностей для улучшения здоровья маленьких пациентов.
Прошло уже больше 30 лет с тех пор, как в кардиологической клинике Бостонской детской больницы появились первые необычные пациенты: дети, спасенные от рака лечением, которое приводило к жизнеугрожающим осложнениям. Осматривал их Стивен Липшульц — детский кардиолог, носивший очки. Их возраст варьировался от дошкольного до подросткового, но объединяло их то, что все они достигли ремиссии лейкоза, лимфомы и других онкологических заболеваний. Они были «новичками» в практике Липшульца, ведь до этого большинство детей с опухолями погибало. Но в 1980-х «медицинское волшебство» было на пороге сотворения. На основе клинических испытаний была создана комбинация лекарственной и лучевой терапии, которая позволяла спасти обреченных до этого детей. Показатели выживаемости пациентов с лейкозом в 1960-х превысили 50 % и продолжали расти. Онкологи и семьи праздновали события, которые до этого казались невозможными: дни рождения, школьные выпускные — их жизнь была избавлена от стресса и страха. «Детям было сказано, что они свободны и здоровы», — говорит Липшульц, который сейчас работает в университете Баффало, являющимся подразделением Государственного университета Нью-Йорка.
Он, однако, обнаружил, что хоть дети и избавились от рака, их здоровье осталось несовершенным. Химио- и лучевая терапия, позволяющие сократить размеры опухоли у пациентов с лимфомой, наносили вред сердцу, но патофизиологию этого процесса он не понимал. Череда пациентов, перенесших лечение несколько месяцев или даже десятков лет назад, тянулась в приемную Липшульца — ослабевшие и едва дышащие.
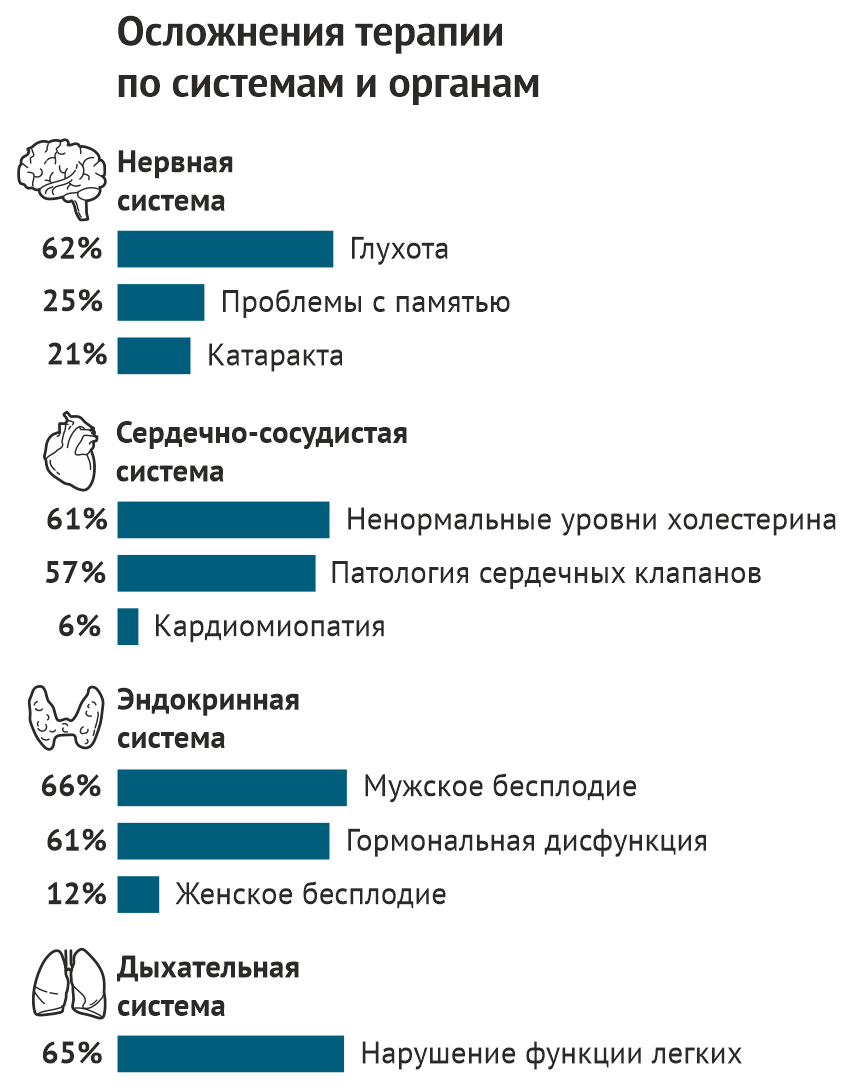
Сложившаяся ситуация стала тревожным сигналом: лечение рака у детей может приводить к серьезным последствиям. Некоторые — те, о которых заботился Липшульц, — страдали от аритмии или сердечной недостаточности. Другие столкнулись с иными проблемами со здоровьем: еще одним онкологическим заболеванием, развившимся на фоне первого лечения, бесплодием, трудностями в учебе, нарушением работы щитовидной железы, нарушением функции легких, развитием почечной недостаточности. Чем больше детей выживало, тем больше врачи узнавали о том, насколько высока цена выживания.
Всего один пациент может заставить осознать проблему. Несколько лет назад Лиза Диллер, детский онколог Института рака «Дана-Фарбер» в Бостоне, пришла в ужас, повстречав тридцатилетнего мужчину, умирающего от рака желудка — заболевания, причиной которого, скорее всего, стала лучевая терапия, проводившаяся для лечения лимфомы Ходжкина еще в подростковом возрасте. «Что, черт возьми, происходит, и что с этим делать?», — задумалась она.
На сегодняшний день частота выздоровления от двух наиболее распространенных среди детей онкологических заболеваний — лимфомы Ходжкина и острого лимфобластного лейкоза стандартного риска — в США и Канаде составляет 90 %. Общая выживаемость детей в течение длительного времени составляет 83 %. Но в исследовании, проведенном в 2014 году, было показано что 80 % из них имеет как минимум одно жизнеугрожающее осложнение к 45 годам. Врачи и исследователи узнают все больше о том, как лечение рака влияет на рост и развитие детских организмов. По мере накопления знаний и увеличения количества выживших (на сегодняшний день в США их количество составляет примерно 500 000 человек), предпринимаются все более активные меры по предупреждению нежелательных эффектов терапии рака.
Чтобы понять патогенез отсроченных побочных эффектов терапии рака и отыскать лучшие пути их профилактики и лечения, ученые создали широкую сеть. Они изучают препараты на рыбках данио-рерио, заставляют больных раком мышей бегать в колесе, исследуют клетки выживших и ДНК детей, которым диагноз был поставлен недавно. И в каждой лаборатории, в каждом разговоре с семьей пациента врачи и ученые будто ходят по канату — их самый большой страх встает на пути выздоровления ребенка от рака, но они стараются создать все условия для сохранения у пациента хорошего здоровья в ближайшие десятилетия после лечения.
«Помню, как я лежал в постели и думал: “Должен ведь быть лучший способ достигнуть этой цели”», — говорит Грегори Аун, детский онколог Научного центра здоровья Техасского университета в Сан-Антонио, руководящий лабораторией, в которой изучают влияние химиотерапии на сердце. Ауну было 16 лет, когда у него диагностировали лимфому Ходжкина. За время лечения он потерял 30 килограмм. В последующие годы у него были проблемы в работе щитовидной железы, а в возрасте 35 лет ему пришлось перенести тройное шунтирование сердечных артерий. Несмотря на то, что лечение привело к бесплодию, у него есть дети: две пары близнецов появились благодаря его сперматозоидам, законсервированным до начала химио- и лучевой терапии. «Мне сказали что рак — это всего лишь необходимость пройти через терапию, после которой все вернется в норму, — говорит Аун. — Но ваша жизнь кардинально меняется. И это та часть онкологии, которую необходимо изменить».
Кири Несс впервые столкнулась с пациентами, перенесшими в детстве онкологическое заболевание, в 2006 году, когда начала работу в детской исследовательской больнице Святого Иуды в Мемфисе, Теннесси. Будучи физиотерапевтом и эпидемиологом, она знала, что примерно у трети выживших к 50 годам развивается новое онкологическое заболевание, которое, вероятно, вызвано повреждением ДНК здоровых клеток в ходе лечения. Помимо этого примерно у 10 % развивается нарушение функции щитовидной железы, у 15 % — сердечная недостаточность, а пациенты, перенесшие облучение головного мозга, во взрослом возрасте реже устраиваются на работу. Наибольшему риску осложнений, в список которых входит бесплодие и почечная недостаточность, подвергаются дети, пережившие трансплантацию костного мозга.
Чтобы лучше изучить долгосрочные эффекты, Несс необходимо было встретиться с выжившими. В госпитале Святого Иуды наблюдают за состоянием нескольких тысяч выживших в течение всей жизни. Один за другим они поступали в ее собственную «лабораторию человеческих характеристик», созданную для изучения их общего состояния здоровья. Несс была поражена. «Они похожи на стариков, — вспоминает она, говоря о взрослых 20, 30 и 40 лет. — У них морщинистая кожа, они ходят медленно, быстро устают и двигаются так, словно они старики».
Но это лишь отражение внутреннего состояния. «Показатели сердечных стресс-тестов и оценки мышечной силы соответствовали показателям, свойственным для людей 70 и 80 лет», — говорит Несс. Ее реакция полностью соответствовала реакции Диллер. «Я спросила: “Что вообще происходит?”».
Несс начала исследование. Она обнаружила, что в ходе лечения рака дети теряют мышечную массу, а после окончания лечения они будто больше никогда не набирают ее снова. Спустя годы, их нервная система будто замедляет свою работу: реакции становятся более вялыми, а когнитивные функции утрачиваются. В 2013 году Несс и коллеги сообщили, что из 1922 выживших детей, достигших возраста 33 лет, примерно у 10 % были диагностированы выраженные нарушения здоровья. Еще у 30 были диагностированы менее выраженные нарушения здоровья, которые сопровождались потерей выносливости и мышечной массы. Их состояние соответствовало таковому у людей старше 65 лет.
Для Несс корень столь раннего старения крылся в основах терапии рака: убивая раковые клетки, химиотерапия и лучевая терапия также повреждают множество здоровых клеток. В поврежденных клетках часто запускается механизм клеточного старения, который позволяет им расходовать меньше энергии. На основании результатов исследований клеточного старения Несс предположила, что у пациентов, перенесших в детстве онкологическое заболевание, «постаревшие» клетки связываются с соседними и запускают в них механизм старения. «Постаревшие» клетки также продуцируют молекулы, которые вызывают в организме вялотекущее воспаление, характерное для стариков.
Несс и коллеги занимаются изучением маркеров биологического старения. Один из них — белок, называемый р16, обычно не обнаруживается у здоровых молодых взрослых. Но исследователи находят его в крови многих выживших, что позволяет предположить схожесть процессов в их организмах с таковыми в организмах стариков.
Кристофер Саросик, онкобиолог Гарвардской школы общественного здравоохранения им. Т. Х. Чана в Бостоне, изучает связь повреждения клеток в процессе лечения с длительной слабостью. Как постдок он занимался изучением формы клеточного самоуничтожения, называемой апоптозом. У здоровых взрослых даже поврежденные клетки были устойчивы к нему. Но в развивающихся тканях мышат он обнаружил, что апоптотические пути были распространены и невероятно активны.
Какова причина? Мышата, как и маленькие дети, растут, а их тела должны быстро избавляться от образовавшихся поврежденных клеток. Вершина этого — апоптоз. Противоопухолевые препараты запускают процессы апоптоза не только в раковых клетках, но и в здоровых развивающихся тканях, увеличивая у молодых пациентов риск повреждения тканей. Саросик ссылается на классический пример — облучение головного мозга. «На головном мозге взрослых вы можете проводить высокодозную лучевую терапию, и у них, скорее всего, не разовьется значительных нейрокогнитивных нарушений. Но если вы подвергаете ей очень маленького ребенка, то можете уничтожить его когнитивные способности», — говорит Саросик. Изучая мышиную модель лучевой терапии, Саросик пытается понять, каким образом противоопухолевая терапия запускает апоптоз в здоровых тканях.
Что бы его ни вызывало, утрата здоровых клеток в ходе лечения может отразиться на дальнейшей жизни, как то было показано в работах Липшульца для сердца. В различных исследованиях он обнаружил, что у детей, получающих популярные химиотерапевтические препараты — антрациклины — происходит потеря кардиомиоцитов, что вначале может протекать бессимптомно или с незначительными проявлениями. Но спустя некоторое время утрата мышечной массы становится проблемой. Сердце растет, мышечные клетки увеличиваются в размерах, а новые не образуются. Когда эти дети достигают совершеннолетия, масса сердца перестает соответствовать размерам тела. Липшульц также обнаружил, что у некоторых выживших развивается истончение стенок сердца или необратимое повреждение сердечной мышцы, что еще больше нарушает работу органа.
Самым поразительным, однако, является расхождение результатов. «Я наблюдаю тридцатилетних реконвалесцентов с абсолютно нормальными сердцами, но есть и те, кто погиб от терапии, или те, кому потребовалась пересадка сердца», — говорит Липшульц.
На сегодняшний день цель состоит в том, чтобы обеспечить новый путь выжившим после рака, и сделать так, чтобы спустя годы им не пришлось наблюдаться у таких врачей, как Липшульц. «Мы не предлагаем не лечить рак», — говорит Брюс Карлтон, клинический фармаколог Университета Британской Колумбии в Ванкувере, Канада. Но знания о том, какой вариант терапии наиболее вреден детям, вероятно, помогут минимизировать последствия.
В больнице Карлтона лечение в 37 % случаев вызывает постоянную потерю слуха у детей с онкопатологией: нарушение, которое навсегда меняет то, как 2-летний ребенок будет учиться понимать речь и взаимодействовать с окружающим миром. В середине 2000-х Карлтон начал охоту за генетическими вариациями, которые повышают или понижают риск утраты слуха и сердечной недостаточности на фоне химиотерапии. Он определил три вариации для потери слуха и еще три для проблем с сердцем. В 2014 году, в качестве части исследования, он и его коллеги стали предлагать пройти тестирование всем пациентам с впервые диагностированным онкологическим заболеванием в Детской больнице Британской Колумбии, расположенной неподалеку.
Одним из пациентов был 13-месячный Эзон Моэн, болезнь которого заставляла сделать мучительный выбор. Он поступил в больницу из города, расположенного в четырех часах езды на север, а между позвоночным столбом и сердцем у него находилась большая опухоль. Диагноз: нейробластома, группа высокого риска — смертельный детский рак. Эзону требовалась лучевая терапия, которая наверняка повредила бы его сердце, а также много доз опасных для здоровья антрациклинов.
Но генетическое тестирование предупредило об опасности. У ребенка было две генных вариации риска антрациклиновой сердечной токсичности, которые, согласно подсчетам лаборатории Карлтона, означали 89 % вероятность тяжелого повреждения сердца. Лучевая терапия лишь увеличила бы эту вероятность. Риск Эзона тревожил. «Мы очень волновались за него», — признался детский онколог Род Рассех.
До той поры Рассех никогда не лечил таких пациентов с нейробластомой, как Эзон, без антрациклинов, но ему пришлось задаться вопросом: нет ли возможности не использовать их? Совместно с коллегами он обнаружил альтернативный европейский протокол, где одна доза антрациклинов комбинировалась с другими химиотерапевтическими препаратами и лучевой терапией. Однако даже одной дозы хватило бы для того, чтобы сердце Эзона остановилось. «Мне захотелось отказаться от этого препарата», — отметила его мать, Ана Моэн.
Больница обратилась за советом к специалисту по этике. В конечном результате все согласились с тем, что родители Эзона под руководством Рассеха приняли обдуманное решение. Лечение Эзона прошло без антрациклинов, хоть и далось нелегко — ему пришлось перенести множество других циклов химиотерапии, лучевой терапии и трансплантацию стволовых клеток. «Был ли я обеспокоен как его онколог? — задается вопросом Рассех. — Я очень нервничал, задумываясь, верное ли решение мы принимаем?».
Прошло больше четырех лет и Рассех смог выдохнуть. В прошлом году Эзон стал посещать детский сад, а в следующем месяце ему исполнится 6 лет. Он излечился от рака, а его сердце отличается восхитительным здоровьем. Его первый бейсбольный сезон стартует этой весной.
«Когда я только начинал, мне казалось что каждая семья хочет обеспечить химиотерапию в полном объеме, чтобы увеличить шансы на выздоровление», – говорит Рассех. Но затем он узнал, что многие семьи готовы отказаться от некоторых видов лечения, если это увеличит их шансы на сохранение здоровья. Рассех вспоминает как лечил нейробластому у 4-летней девочки за десять лет до того, как стало доступно генетическое тестирование. Пересмотрев ее случай он обнаружил, что у нее имелись те же генные вариации, что и у Эзона. Спустя год после терапии девочке потребовалась трансплантация сердца, а когда она оказалась несостоятельной, потребовалась повторная.
В этом году Карлтон внедрил генетическое тестирование еще в девять детских больниц по всей Канаде. Усилия, направленные на секвенирование генов, находятся на этапе реализации. Одним из самых крупных исследований стало исследование выживаемости детей после рака (Childhood Cancer Survivor Study — CCSS), стартовавшее в 1994 году. В него вошли более 25 000, перенесших рак в период с 1970 по 1999 гг. в США и Канаде. «К концу года в CCSS секвенируют экзомы (кодирующие белки ДНК) более чем у 8000 из них», – говорит Грег Армстронг, детский нейроонколог больницы Святого Иуды и ведущий исследователь CCSS.
Такое изменение протокола терапии как у Эзона не всегда возможно. Более чем в 4000 тысячах километров от Ванкувера сотрудник группы Британской Колумбии изучает другие возможности использования результатов генетического тестирования. «Мы не собираемся прекращать применение антрациклинов у всех, — говорит Джейсон Бирман, детский онколог Университета Далхаузи в Галифаксе на востоке Канады. — Но, возможно, мы подберем защищающие препараты, особенно для пациентов склонных к развитию токсических эффектов».
В свободное от больных детей время Бирман руководит лабораторией рыбок данио-рерио и использует этих небольших тропических рыбок для скрининга десятков потенциальных лекарств. До сих пор он сталкивался с двумя препаратами, которые защищали сердце рыбы от повреждения антрациклинами, но не ослабляли их химиотерапевтического воздействия на раковые клетки. Поскольку в его больнице планируется внедрение генетического тестирования Карлтона, в конечном результате Берман планирует испытать новые защитные соединения на детях с крайне высоким риском повреждения сердца.
Один из этих препаратов уже доступен. Дексразоксан одобрен в США для минимизации повреждения сердца у пациенток с раком груди и иногда назначается детям, получающим противораковую терапию. Впервые Липшульц провел тестирование дексразоксана на детях в 1990-х годах. Сейчас врачи изучают, насколько хорошо дексразоксан помогает справиться с нарушением работы сердца спустя годы после лечения. Липшульц, детский онколог Эрик Чоу из Центра исследования раковых заболеваний Фреда Хатчинсона в Сиэтле, Вашингтон, с коллегами наблюдают за состоянием сотен взрослых, получивших дексразоксан в ходе этих ранних испытаний.
Некоторые исследователи задаются вопросом, могут ли обычные упражнения защитить сердце. В онкологическом центре имени М. Д. Андерсона Техасского университета в Хьюстоне, детский онколог Евгения Клейнерман изучает, может ли энергичная ходьба снизить риск повреждения сердца у детей с остеосаркомой. Как и у многих в этой области, у нее есть трагическая история, заставившая ее встать на этот путь. Кляйнерман вылечила молодую женщину от саркомы и спустя годы узнала, что она потеряла сознание и погибла от сердечного приступа на баскетбольной площадке Мичиганского колледжа. Кляйнерман создала мышиную модель лечения остаосаркомы, в которой сердца животных повреждались препаратом антрациклинового ряда — доксорубицином. Дважды в неделю они получали инфузии препарата, после чего на 45 минут их помещали в беговое колесо. Данные эхокардиографии и аутопсий показали, что сразу после химиотерапии, а также спустя 2 месяца, сердца мышей, подвергавшихся физической нагрузке, не отличались от таковых у мышей, не получавших лечения. Данные исследования Кляйнерман в апреле 2018 года были опубликованы в журнале Детская Гематология/Онкология.
В конце прошлого года она запустила пилотное исследование, направленное на определение целесообразности программы упражнений для подростков и молодых взрослых с остеосаркомой, опухоли у которых зачастую локализуются в нижних конечностях. Если это возможно, Клейнерман надеется, что она сможет запустить крупное испытание, чтобы проверить, может ли данная стратегия сохранить сердца здоровыми.
Некоторые детские онкологи считают, что мы стоим на пороге перемен. Их арсенал — по большей части из 1980-х или более ранних лет, поскольку новые терапевтические тактики почти всегда предназначены для взрослых, — наконец расширяется. Новая таргетная терапия и иммунотерапия могут оказывать меньшие и, конечно, разнообразные долгосрочные эффекты. Между тем клинические испытания помогли в выявлении пациентов с низким риском рецидива или смерти. Такие дети могут иногда избежать опасной терапии. Даже среди пациентов с медуллобластомой — одной из самых агрессивных форм детского рака, поражающего головной мозг, — ученые изучают возможности безопасного снижения доз лучевой терапии в группе пациентов с низким риском. В 2016 году Армстронг с коллегами из CCSS в The New England Journal of Medicine сообщили о заметном эффекте более мягкого лечения: в начале 1970-х годов, спустя 15 лет с момента постановки диагноза, в детском возрасте погибало 12 % пациентов с любыми онкологическими заболеваниями, тогда как в начале 1990-х количество погибших составляло 6 %.
В свои 45 лет Аун все еще пытается ужиться с осложнениями противоопухолевой химиотерапии. Недавно он осознал, что словно вглядывается в кривое зеркало: перед ним сидела девушка 16 лет — возраст, в котором ему поставили диагноз, — и у нее была лимфома Ходжкина. И все же ее путь был другим. Ее лечение длилось всего 3 месяца, тогда как у него — девять. Она быстро вернулась к полноценному посещению школы, тогда как ему потребовался дополнительный год обучения. Благодаря проведенному десять лет назад клиническому испытанию, в котором предполагалось, что большинство пациентов с лимфомой Ходжкина не нуждается в агрессивной терапии, ей удалось избежать облучения грудной клетки, которое приводило к развитию рака груди к 40 годам у каждой третьей девочки с такой патологией. «У нее все будет хорошо», — предсказывает Аун. Теперь, по его словам, ему и другим предстоит создать такое же светлое будущее для тех, кому еще предстоит выжить.
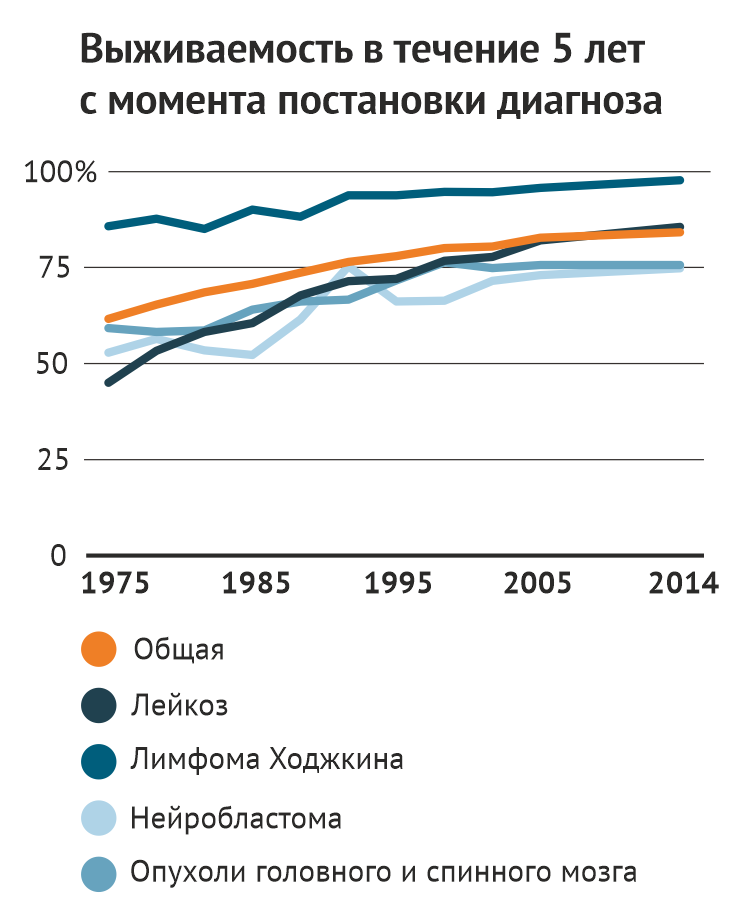
Когда-то рак у детей был приговором, но сегодня более чем 80 % детей и подростков выживает в течение длительного времени. На графике показана выживаемость в зависимости возраста, в котором ребенку был установлен диагноз.
