Travel-формат: основные биологические принципы метастазирования
Несмотря на значительные успехи в изучении, диагностике и лечении рака, большая часть пациентов с запущенной стадией метастатического процесса имеют крайне неблагоприятный прогноз. Подавляющее большинство смертей, связанных со злокачественными новообразованиями (около 90 %), вызвано метастатическим поражением, а не первичной опухолью.
Распространение опухолевых клеток из первичной локализации и последующий рост новых опухолевых колоний в отдалении от источника — это многоэтапный процесс, известный как каскад инвазии и метастазирования. Он включает в себя следующие этапы инвазии первичных опухолевых клеток в окружающие ткани: интравазацию (перемещение в систему кровообращения) и выживание при гематогенном транзите, остановку и экстравазацию через стенки сосудов в отдаленные от источника опухоли ткани, образование микрометастатических колоний в них, последующую пролиферацию микроскопических колоний в клинически обнаруживаемые метастазы (колонизация) [1].
«Притяженья больше нет»
Генерализация опухолевого процесса происходит с помощью двух механизмов: распространения отдельных клеток через эпителиально-мезенхимальную пластичность (ЭМП) или коллективного распространения опухолевых кластеров. Предполагается, что клетки-лидеры опухолевых кластеров также претерпевают определенные фенотипические изменения, связанные с ЭМП.
Хотя традиционные модели канцерогенеза предполагают, что метастазирование является поздним событием в ходе многоэтапного прогрессирования опухоли, приобретение признаков, связанных с ЭМП, может происходить относительно рано, и процесс генерализации иногда проявляется даже в некоторых фоновых и предраковых поражениях [2].
Эпителиальное состояние — привычное, будничное, низкоэнергетическое. Когда же клетки подвергаются ЭМП, они претерпевают последовательные изменения, причем каждое новое состояние приближается к мезенхимальному фенотипу, имеющему более высокий уровень свободной энергии. То есть это не два устойчивых состояния клетки, а целый комплекс промежуточных стадий. Именно поэтому современный термин использует понятие эпителиально-мезенхимальная пластичность, а не «переход», как было предложено изначально. При этом индукция полностью мезенхимального состояния, достигаемая экспериментально посредством введения высоко экспрессированных транскрипционных факторов ЭМП, в результате завершения всей программы ЭМП приводит к утрате способности инициировать опухолевый рост и, соответственно, формировать метастатические колонии [3]. Это доказывает, что фенотипическая пластичность, свойственная клеткам в середине эпителиально-мезенхимального спектра, имеет наибольшее значение для образования метастазов и их последующего устойчивого роста.
Вместе весело шагать по просторам?
Злокачественно трансформированные клетки могут интравазировать в кровеносное русло либо в виде одиночных циркулирующих опухолевых клеток (ЦОК), либо в виде многоклеточных кластеров ЦОК. Кровоток представляет собой неблагоприятную среду с агрессивными факторами в виде естественных киллеров или угрозы механического повреждения, приводящего к фрагментации (внутрисосудистое давление, скорость кровотока, тонус стенок, форменные элементы крови). Опухолевые клетки получают физическую и иммунную защиту, благодаря действию тромбоцитов, которые покрывают ЦОК вскоре после их интравазации. Нейтрофилы могут обеспечивать защиту от атак NK, а также дальнейшую «стыковку» с эндотелием и экстравазацию ЦОК. Коллективные эффекты этих взаимодействий способствуют трансэндотелиальной миграции ЦОК, чему также могут содействовать макрофаги, связанные с метастазированием в ткани-мишени [4].
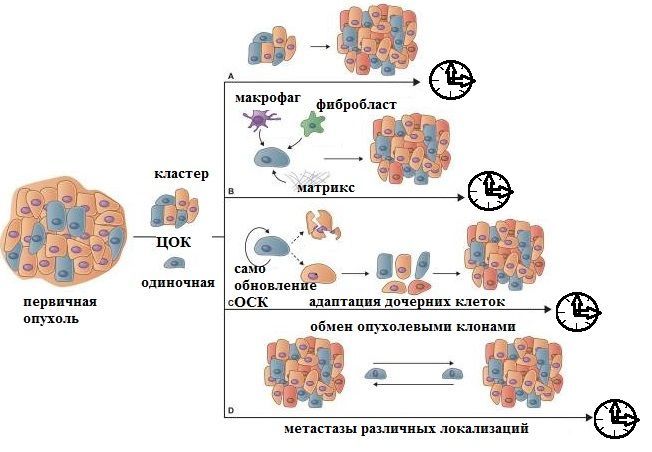
Рисунок 1 | Динамика метастатической эволюции.
Кинетика метастатической колонизации весьма вариабельна. Обобщенно можно выделить четыре гипотетических альтернативных варианта:
(A) Распространение кластеров ЦОК может вызывать клинически обнаруживаемые метастазы за относительно короткий промежуток времени от момента инициации метастатического процесса, поскольку такие кластеры очень эффективны в формировании метастазов. Чаще такие колонии демонстрируют гомотипические межклеточные взаимодействия в среде чужеродных тканей (объясняя «излюбленные» типичные метастазы при различных локализациях источника).
(Б) Одиночные клетки диссеминированной опухоли, которые способны к рекрутингу и созданию поддерживающей метастатической ниши или способны сами создавать микросреду ниши, имеют больше шансов выжить и быстрее инициировать программы пролиферации.
(C) Для пролиферации мигрирующих/циркулирующих опухолевых стволовых клеток, инициации ими роста метастатического очага, генерации и эволюции потомства, хорошо адаптированного к локальной микросреде, требуется больше времени (месяцы/годы).
(D) На более поздних стадиях прогрессирования метастатического процесса появляются новые пути эволюции: обмен клонами метастатических клеток между различными метастатическими поражениями у одного и того же пациента со взаимовыгодной трансформацией.
Если ты скажешь «да»
Отсутствие «положительного подкрепления» со стороны будущей опухолевой ниши блокирует трансэндотелиальную миграцию, в таком случае ЦОК могут пролиферировать внутрисосудисто (крайне редко) или вызывать некроз в эндотелиальных клетках.
«Это так просто, вкл/выкл» или режимы покоя/ниши
Клетки карциномы могут сохраняться в отдаленных тканевых средах в виде дремлющих диссеминированных опухолевых клеток (наиболее изучен этот процесс во внутрикостных метастазах). Считается, что пациенты с такими «резервуарами» имеют минимальное остаточное заболевание, но повышенный риск возможного метастатического рецидива.
Дремлющие диссеминированные опухолевые клетки поддерживают свое существование за счет уникальных биохимических сигнальных путей, называемых программами/режимами покоя. Сигналы от метастатической микросреды, такие как CXCL12, могут активировать SRC и AKT, что способствует выживанию клона. Сниженная интегрин-опосредованная митогенная передача сигналов в сочетании с действиями цитокинов запускает программу покоя, которая связана с состоянием передачи сигналов ERK low / p38 high [5].
Также дремлющие опухолевые клетки могут находиться в «спящих» нишах, таких как ниша гемопоэтических стволовых клеток или периваскулярная ниша. Тромбоспондин-1 (TSP1), локализованный в базальной мембране зрелых кровеносных сосудов, способствует поддержанию покоящегося состояния. «Спящие» клетки могут уклоняться от обнаружения NK-клетками посредством репрессии NK-активирующих лигандов [5,6].
Таким образом, можно сформулировать ряд общих биологических принципов метастатического каскада:
1. Метастазирование — последовательный многоэтапный процесс, который можно представить как каскад инвазии и собственно метастазирования, со значительной вариабельностью сроков и путей собственного развития (Рис.1).
2. В случае эпителиальных злокачественных новообразований программа ЭМП позволяет первичным опухолевым клеткам преодолеть межклеточные контакты за счет перехода в более высокоэнергетическое состояние.
3. Судьба «оторвавшихся» клеток карциномы зависит от изменений, которые они претерпевают во время транзита через кровеносную систему.
4. Далее опухолевым клеткам необходимо избежать элиминации иммунной системой и разрушить клеточные программы, которые вызывают состояние покоя.
5. Активность метастатической колонизации зависит от свойств ЦОК: насколько они компетентны, чтобы инициировать рост опухоли, способны ли их дочерние клетки создать гибкие, специфичные для конкретного органа программы колонизации и трансформировать ткани органа в благоприятную опухолевую микросреду, способствующую активной пролиферации и выживанию.
Источники
1. Talmadge JE, Fidler IJ. AACR centennial series: the biology of cancer metastasis: historical perspective. Cancer Res. 2010 Jul 15;70(14):5649-69.
2. Rhim AD, Mirek ET, Aiello NM, Maitra A, Bailey JM, McAllister F, Reichert M, Beatty GL, Rustgi AK, Vonderheide RH, Leach SD, Stanger BZ. EMT and dissemination precede pancreatic tumor formation. Cell. 2012;148:349–361.
3. Ocana OH, Corcoles R, Fabra A, Moreno-Bueno G, Acloque H, Vega S, Barrallo-Gimeno A, Cano A, Nieto MA. Metastatic colonization requires the repression of the epithelial-mesenchymal transition inducer Prrx1. Cancer cell. 2012;22:709–724.
4. Cheung KJ, Padmanaban V, Silvestri V, et al. Polyclonal breast cancer metastases arise from collective dissemination of keratin 14-expressing tumor cell clusters. Proc Natl Acad Sci U S A. 2016;113(7):E854–E863.
5. Peinado H, Zhang H, Matei IR, et al. Pre-metastatic niches: organ-specific homes for metastases. Nat Rev Cancer. 2017 May;17(5):302-317.
6. Coffelt SB, Kersten K, Doornebal CW, et al. IL-17-producing γδ T cells and neutrophils conspire to promote breast cancer metastasis. Nature. 2015;522(7556):345–348.
