Терапия опухолей легкого с использованием эпидермального фактора роста: новые возможности преодоления резистентности

Рак легкого является ведущей причиной мировой смертности от онкологических патологий. Около 85 % всех опухолей легкого являются немелкоклеточными: эта категория включает такие гистологические подтипы опухолей, как аденокарцинома, плоскоклеточная и крупноклеточная карциномы легкого. Ведущая роль в образовании этих опухолей принадлежит герою сегодняшнего материала — EGFR.
EGFR (epidermal growth factor receptor, рецептор эпидермального фактора роста) является одним из четырех членов семейства человеческих эпидермальных рецепторов (human epidermal receptors, HER) и представляет собой гликопротеиновый трансмембранный белок. Структура EGFR кодируется онкогеном и позволяет отнести его к группе рецепторов тирозинкиназ. В строении EGFR выделяют С-концевой внутриклеточный участок, который управляет киназной активностью, N-концевой внеклеточный участок, связывающийся с соответствующим лигандом, а также гидрофобный трансмембранный домен [1].
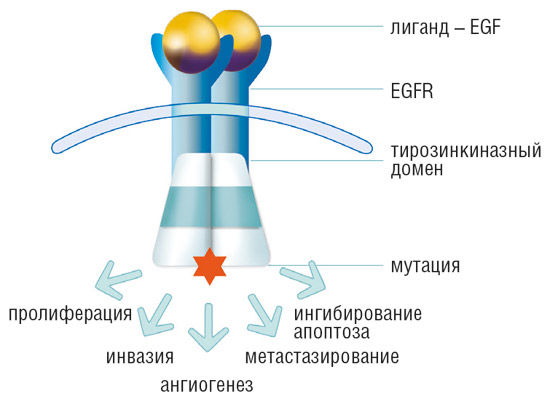
Рисунок 1 | Строение EGFR и основные следствия его активации.
В норме EGFR регулирует цепи ферментативных реакций, отвечающих за рост и развитие эпителиальных тканей. Активация этого белка ведет к инициации киназного каскада, регулирующего клеточную пролиферацию, дифференцировку и выживание [2]. В условиях патологии активация EGFR приводит к формированию опухолей, наиболее часто это встречается в случае немелкоклеточных опухолей легкого. В генезе данных новообразований могут играть роль такие состояния, как аномальное повышение выработки EGFR, мутация его гена, лиганд-зависимая димеризация рецептора или лиганд-независимая его активация. В данном случае повышение тканевого уровня этого протеина ассоциируется с достижением опухолью поздних стадий своего развития и плохим прогнозом [3].
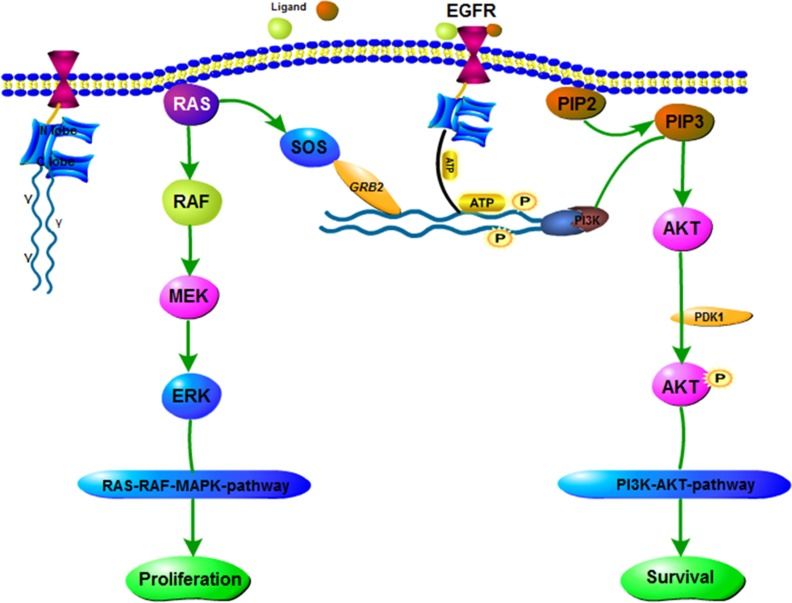
Рисунок 2 | Сигнальные пути, активируемые EGFR.
EGFR и участники активируемых им сигнальных путей активно используются в разработке средств таргетной терапии. Используемые препараты таргетной терапии против EGFR подразделяются на средства на основе химерных моноклональных антител (например, панитумумаб и цетуксимаб) и тирозинкиназные ингибиторы (гефитиниб, эрлотиниб, афатиниб) [4]. Механизм действия последних заключается в замедлении фосфорилирования EGFR и блокаде сигнальных путей. В конечном итоге это приводит к снижению скорости пролиферации опухолевых клеток и препятствует их выживанию [5].
В клинических исследованиях было доказано, что EGFR-направленная терапия опухолей легкого является более эффективной, чем химиотерапия, особенно при использовании тирозинкиназных ингибиторов. Существующая на сегодняшний день гетерогенность опухолей легкого и стремительно развивающаяся фармакорезистентность существенно ограничивают возможности использования агентов, направленных против EGFR. Вследствие этого в настоящий момент активно проводится разработка препаратов, ингибирующих EGFR у пациентов, резистентных к уже имеющимся методикам.
Существует несколько вариантов преодоления фармакорезистентности. Например, усилить эффективность препаратов таргетной терапии возможно при использовании микроРНК. Роль микроРНК в регуляции метаболизма клетки сводится к контролю экспрессии генов. По современным данным, возрастание уровня микроРНК в ткани опухоли положительно коррелирует с развитием резистентности к препаратам против EGFR, что делает возможным использование этих агентов для преодоления фармакорезистентности к препаратам таргетной терапии и увеличивать продолжительность жизни пациентов с опухолями легкого. Также было установлено, что некоторые подтипы микроРНК могут направленно воздействовать на EGFR и самостоятельно становиться агентами таргетной терапии.
Не менее важная роль в эпигенетической регуляции жизни EGFR-положительных опухолевых клеток отводится длинным некодирующим РНК. Еще одним способом усиления эффективности средств против EGFR является их комбинирование с ингибиторами другого члена семейства эпидермальных рецепторов — HER3 [2, 7]. Препараты с описанными эффектами на данный момент не прошли апробацию и не могут использоваться у пациентов с немелкоклеточными опухолями легких, однако в перспективе такие средства могут получить широкое применение.
Стоит отметить, что EGFR изучается на протяжении длительного времени; внимание к нему не ослабевает из-за возможности использования его как агента таргетной терапии. Разработка новых препаратов, позволяющих снизить резистентность опухолей к таргетным воздействиям, может привести к существенному снижению смертности от карцином, что и является главной целью прецизионной медицины.
Источники:
- Extracellular region of epidermal growth factor receptor: a potential target for anti-EGFR drug discovery. / Dokala A, Thakur SS. // Oncogene. - 2017. - Vol. 36, №17. - p. 2337-2344.
- Epidermal growth factor receptor (EGFR): a rising star in the era of precision medicine of lung cancer. / Xiaomin Liu, Ping Wang, Caiyan Zhang [et al]. // Oncotarget. - 2017. - Vol. 8, №30. - p. 50209-50220.
- Review on EGFR inhibitors: critical updates. / Singh D, Attri BK, Gill RK [et al]. // Mini Rev Med Chem. - 2016. - Vol. 16, №14. - p. 1134-1166.
- Structural basis for drug resistance mechanisms against EGFR. / Goyal S, Jamal S, Shanker A [et al]. // Curr Top Med Chem. - 2017. - Vol. 17, №22. - p. 2509-2521.
- Study of EGFR signalling/endocytosis by side-directed mutagenesis. / Wang Q, Wang Z. // Methods Mol Biol. - 2017. - Vol. 1652. - p. 135-143.
- Covalent EGFR inhibitors: binding mechanisms, synthetic approaches, and clinical profiles. / Hossam M, Lasheen DS, Abouzid KA. // Arch Pharm (Weinheim). - 2016. - Vol. 349, №8. - p. 573-593.
- Dual targeting of HER3 and EGFR in colorectal tumors might overcome anti-EGFR resistance. / Temraz S, Mukherji D, Shamseddine A. // Crit Rev Oncol Hematol. - 2016. - Vol. 101. - p. 151-157.
