Физиологическая роль системы урокиназного активатора плазминогена и участие ее компонентов в онкогенезе
Цикл материалов об онкомаркерах продолжается, и на этот раз нашим героем становится система урокиназного активатора плазминогена, а именно — несколько белков, играющих ключевые роли в росте и инвазии опухоли.
Урокиназный активатор плазминогена (УАП, urokinase plasminogen activator, uPA) представляет собой трипсиноподобную сериновую протеазу. Вместе со своим рецептором (urokinase plasminogen activator receptor, uPAR) и ингибиторами двух типов (plasminogen activator inhibitor type 1, 2; PAI-1, PAI-2) урокиназный активатор плазминогена составляет одноименную группу, имеющую большое функциональное значение в условиях нормы и патологии. Впервые данный белок был обнаружен в моче человека, затем была установлена его локализация в множестве тканей организма [1].
В организме человека УАП синтезируется в форме функционально неактивного одноцепочечного полипептида. В структуре такого УАП выделяют три специфических участка:
- домен эпидермального фактора роста (необходим для связывания с соответствующим рецептором);
- крингл-домен (формирует участки связывания для компонентов системы фибринолиза);
- каталитический домен (опосредует запуск внутриклеточных сигнальных путей).
Для приобретения белком функциональной активности одна из его связей подвергается гидролизу, что формирует двухцепочечную структуру. Также возможна деактивация УАП при воздействии тромбина, который запускает гидролиз одной из связей в одноцепочечной молекуле и лишает ее дальнейшей функциональной активности [2].
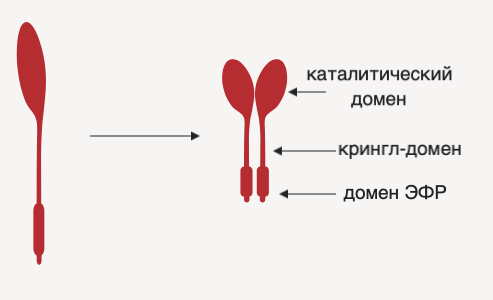
Рисунок 1 | Строение урокиназного активатора плазминогена.
Основная физиологическая роль урокиназного активатора плазминогена понятна из названия этого протеина. Опосредуя переход плазминогена в плазмин, УАП участвует в процессах фибринолиза, что позволяет использовать его как средство борьбы с тромбоэмболическим синдромом (например, в насыщающей дозе 4400 МЕ/кг при ТЭЛА). Кроме того, плазмин активирует металлопротеиназы экстрацеллюлярного матрикса, запуская тем самым его деградацию и разрушение базальной мембраны [3].
Деградация и ремоделирование экстрацеллюлярного матрикса имеет место и в физиологических условиях. Те же процессы оказываются крайне важными в микроокружении опухоли на ранних этапах канцерогенеза. Действие урокиназного активатора плазминогена приводит к увеличению объема опухолевой массы, выработке факторов роста опухоли, активации цитокинов и индукции пролиферации, миграции и инвазии опухолевых клеток. Регуляция активности внутриклеточных ферментов посредством УАП поддерживает жизнеспособность опухолевой клетки. Кроме того, компоненты системы УАП участвуют в процессах эпителиально-мезенхимального перехода, имеющего большое значение для метастазирования опухоли. Таким образом, вследствие активации компонентов системы УАП формируется характерный фенотип опухолевых клеток. При этом в процессе онкогенеза наблюдается изменение активности УАП, вызванное нарушением экспрессии его гена [4].
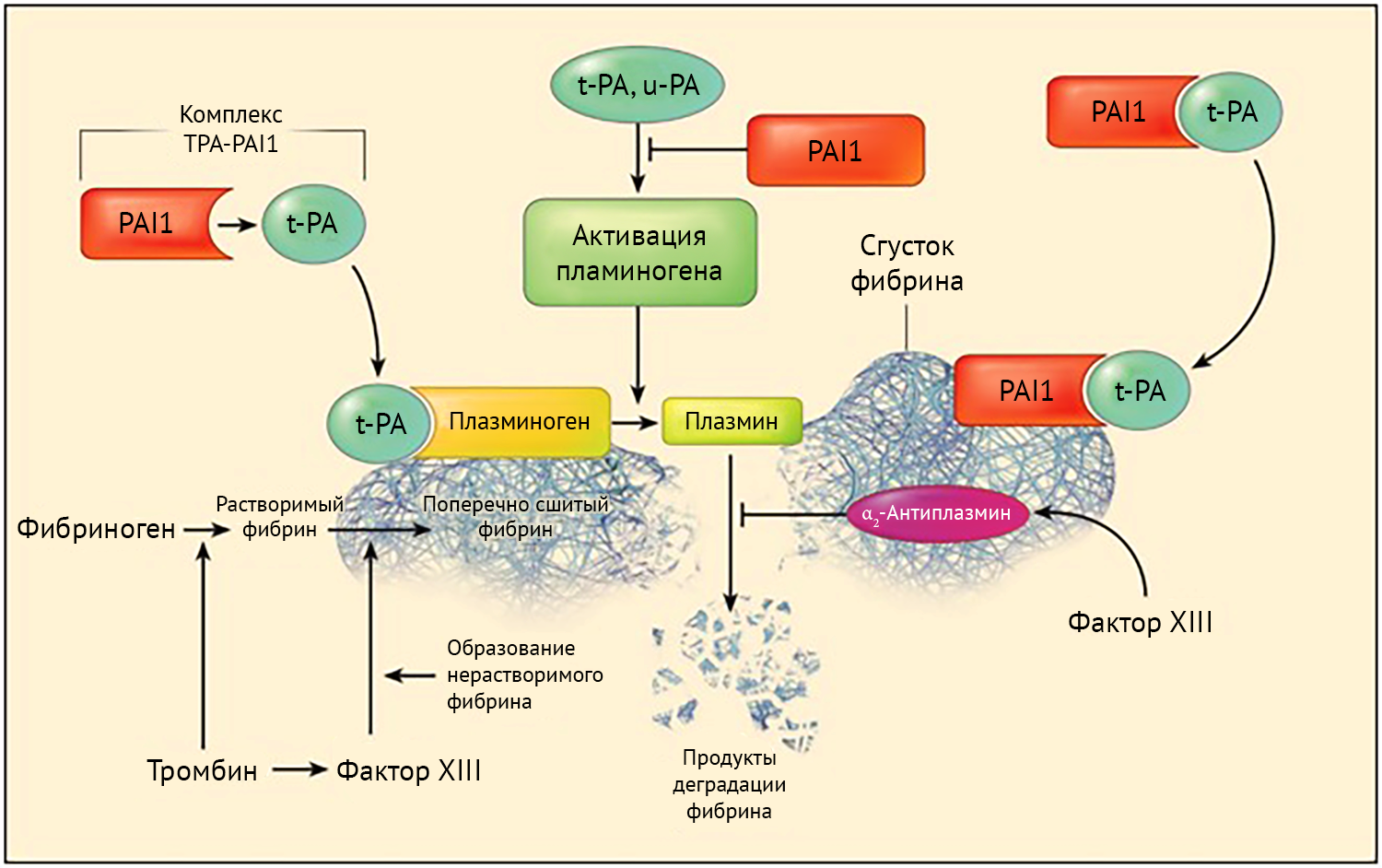
Рисунок 2 | Функциональная активность компонентов системы урокиназного активатора плазминогена.
Определение уровня компонентов системы УАП в сыворотке крови проводится с использованием различных серологических методов. В случае многих новообразований отмечается положительная корреляция между сывороточными уровнями компонентов системы УАП и негативным прогнозом в отношении выживаемости пациентов. Это особенно актуально для рака молочной железы, в случае которого обнаружение высокого уровня сывороточного урокиназного активатора плазминогена ассоциируется с ускоренным метастазированием опухоли. При этом инвазия злокачественных клеток опосредуется несколькими механизмами, зависящими от УАП, включая сигнальные пути Ras-ERK и MAPK [5].
В настоящее время УАП является привлекательной целью для разработки препаратов химиотерапии. Современные разработки препаратов таргетной терапии включают в себя возможности антисмысловой терапии и технологии РНК-интерференции. Пока эти разработки доступны только на мышиных моделях, но не исключено, что в ближайшее время аккредитацию пройдут первые препараты для приема человеком [6].
В наше время перед исследователями предстают уже известные физиологически активные вещества и молекулы, которые обретают патологическое значение в условиях канцерогенеза. Урокиназный активатор плазминогена и другие компоненты его системы несомненно относятся к представителям таких протеинов. Одной из главных задач современных исследований является определение возможности применения таргетной терапии в отношении подобных агентов, что крайне необходимо для снижения заболеваемости и смертности от онкологической патологии.
Источники:
- Urokinase type plasminogen activator and the molecular mechanisms of its regulation in cancer. / Santibanez JF. // Protein Pept Lett. — 2017. — Vol. 24, №10. — p. 936–946.
- The urokinase-type plasminogen activator (uPA) system as a biomarker and therapeutic target in human malignancies. / Su SC, Lin CW, Yang WE [et al]. // Expert Opin Ther Targets. — 2016. — Vol. 20, №5. — p. 551–566.
- Involvement of urokinase-type plasminogen activator system in cancer: an overview. / Mekkawy AH, Pourgholami MH, Morris DL. // Med Res Rev. — 2014. — Vol. 34, №5. — p. 918–956.
- The urokinase plasminogen activator system in breast cancer invasion and metastasis. / Tang L, Han X. // Biomed Pharmacother. — 2013. — Vol. 67, №2. — p. 179–182.
- Targeting urokinase-type plasminogen activator and its receptor for cancer therapy. / Nozaki S, Endo Y, Nakahara H [et al]. // Anticancer Drugs. — 2006. — Vol. 17, №10. — p. 1109–1117.
- Ligand binding modulates the structural dynamics and activity of urokinase-type plasminogen activator: a possible mechanism of plasminogen activator. / Tobias Kromann-Hansen, Eva Louise Lange, Ida K Lund [et al]. // PLoS One. — 2018. — Vol. 13, №2.
- Plasminogen-activator inhibitor type 1 and coronary artery disease. / Kohler HP, Grant PJ. // NEJM. — 2000. — Vol. 342. — p. 1792–1801.
