Нейтрофильные внеклеточные ловушки: механизм образования и функции

Нейтрофилы — наиболее распространенный вид лейкоцитов. Они являются важной составляющей врожденного иммунитета и представляют собой первую линию защиты организма от инфицирования бактериями, грибами и простейшими. Фагоцитоз и секреция антимикробных веществ из гранул — не единственные функции нейтрофилов. В 2004 году был открыт еще один механизм борьбы с микробной инвазией: формирование нейтрофильных внеклеточных ловушек (NET — neutrophil extracellular traps). Эти ловушки позволяют нейтрофилам уничтожать внеклеточные патогены при минимальном повреждении клеток хозяина.
Механизм образования NETs
Основными компонентами внеклеточных нейтрофильных ловушек являются гистоны, ферменты и пептиды гранул (нейтрофильная эластаза, миелопероксидаза, катепсин G, лактоферрин, желатиназа, лизоцим С, кальпротектин и другие). Процесс образования NETs называется NETosis и может быть вызван различными индукторами: микроорганизмами, бактериальными компонентами, активированными тромбоцитами, комплементарными пептидами, аутоантителами, IL-8, перекисью водорода, кристаллами урата, сигаретным дымом. После контакта индуктора с рецепторами на мембране клетки активируется молекулярный каскад, который приводит к выходу кальция из эндоплазматического ретикулума, что в свою очередь вызывает повышение активности цитоплазматической деиминазы PAD4. Наряду с этим уменьшается конденсация хроматина. Через некоторое время нейтрофилы теряют гетерохроматические области ядра, в результате чего ядра расширяются и становятся круглыми. Ядерная оболочка распадается на везикулы, мембраны гранул и митохондрий разрушаются, что приводит к смешению цитоплазмы, кариоплазмы и антибактериальных пептидов. Белки гранул адсорбируются на отрицательно заряженных фибриллах деконденсированного хроматина, который служит скелетом для ловушки. В конечном итоге клеточная мембрана разрывается и содержимое клетки выбрасывается наружу и разворачивается в пространстве, образуя сеть [1].
Описанный механизм называется suicidal NETosis (суицидальный нетоз). Однако известно, что нейтрофилы могут продуцировать NET, выделяя часть ядра или ядро целиком, и не нарушать целостность клеточной мембраны. Такой механизм получил название vital NETosis (прижизненный нетоз). Эти две формы одного и того же процесса имеют существенные различия. Во-первых, суицидальный нетоз вызывается в основном химической стимуляцией гранулоцитов и требует несколько часов для продукции NET, в то время как прижизненный нетоз активируется при раздражении нейтрофилов бактериальными агентами и занимает меньшее время. Во-вторых, vital NETosis не приводит к лизированию клетки, и она сохраняет способность к хемотаксису и фагоцитозу. Третье отличие заключается в механизме выпуска ловушек. Как было описано выше, при суицидальном нетозе происходит деконденсация хроматина, растворение ядерной оболочки и выброс содержимого клетки через перфорацию в плазматической мембране. Во время прижизненного нетоза происходит перенос ДНК из ядра во внеклеточное пространство с помощью везикул. Везикулы с ДНК, отделившиеся от ядра, проходят через цитоплазму и сливаются с клеточной мембраной, тем самым выбрасывая NET из клетки без перфорации мембраны [2].
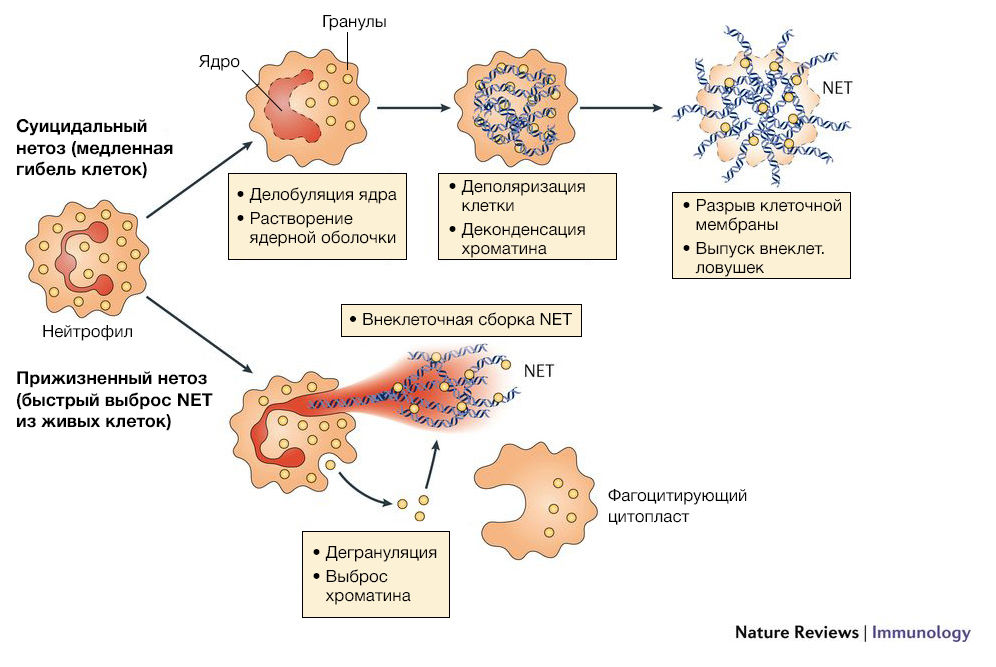
Источник: Nature Reviews Immunology
Антимикробные функции NETs
Антимикробная функция внеклеточных нейтрофильных ловушек связана с уничтожением микроорганизмов, а также с предотвращением их распространения из точки входа. Отрицательно заряженная ДНК служит каркасом для компонентов NET, одновременно захватывая и удерживая микроорганизмы. Бактерии, продуцирующие нуклеазы, могут расщеплять ловушки и высвобождаться из них, что способствует распространению бактерий за пределы места инвазии. Например, род Streptococcus, вызывающий у людей опасные заболевания, продуцирует нуклеазы. Ингибирование экспрессии ДНКаз способствует снижению вирулентности, а индуцирование их экспрессии способствует образованию гипервирулентной формы стрептококков [1] [2].
NETs также эффективны против грибов. Они могут захватывать и уничтожать как дрожжевые, так и гифальные формы. Причем дрожжевые формы грибов задерживаются относительно низким количеством нейтрофилов, тогда как штаммы, образующие гифы, подвергаются атакам большего числа гранулоцитов [1].
Роль NETs в тромбозе
Хотя патогенез артериального и венозного тромбоза различен, в обоих этих процессах принимают участие NETs. При венозном тромбозе активированный эндотелий высвобождает фактор фон Виллебранда и P-селектин, которые привлекают тромбоциты и нейтрофилы. Во время активации тромбоциты индуцируют нейтрофилы, и те высвобождают внеклеточные ловушки, которые становятся каркасом для построения тромба и адгезии тромбоцитов. NETs способствует расщеплению ингибитора тканевого фактора и стимуляции Ха фактора [3].
NETs также играют значимую роль в образовании атеросклеротических бляшек, которые могут привести к артериальному тромбозу. При контакте нейтрофилов с кристаллами холестерина может спонтанно запускаться нетоз, который приводит к задержке тромбоцитов, активации коагуляции и образованию артериальных тромбов [4].
NETs при заболеваниях легких
Муковисцидоз (кистозный фиброз) — наследственное заболевание, при котором происходит мутация гена трансмембранного регулятора муковисцидоза. Пациенты с этим заболеванием страдают от скопления вязкой слизи в легких, которая закупоривает дыхательные пути. Различные инфекции легких, которые развиваются на фоне этого заболевания, вызывают массивную инфильтрацию нейтрофилами и хроническое воспаление. Слизь у больных муковисцидозом содержит большое количество ДНК, большая часть которой находится в NETs [5]. Количество внеклеточной ДНК напрямую коррелирует со сниженной функцией легких [6]. Для симптоматического лечения можно использовать ингаляции ДНКазы I. При этом уменьшается вязкость слизи и улучшается функция легких, однако возрастает риск высвобождения высокоактивных ферментов и токсинов, которые могут повредить эпителий легких [1].
При хронической обструктивной болезни легких также обнаруживается большое количество нейтрофилов в легочной ткани. После длительного воздействия на дыхательные пути раздражителей, например, табачного дыма, больные начинают страдать от рецидивирующих бактериальных и вирусных инфекций, приводящих к повторным обострениям. Табачный дым провоцирует образование нейтрофильных внеклеточных ловушек. Кроме того, никотин непосредственно вызывает нетоз. Как и в случае с муковисцидозом, при тяжелой степени ХОБЛ повышается содержание NETs в слизи, особенно в фазе обострения [1].
NETs и рак
Длительное время считалось, что нейтрофилы остаются инертными по отношению к раковым клеткам во время роста опухоли и метастазирования. Однако в недавнем исследовании пациентов с саркомой Юинга в 25 % случаев NETs были найдены внутри опухоли. Впоследствии у этих пациентов появились метастазы, что указывает на то, что внеклеточные нейтрофильные ловушки могут способствовать прогрессированию опухоли [7].
В исследовании, сравнивающем две линии мышей с раком молочной железы (метастатическим и не метастатическим), было обнаружено большое количество нейтрофилов в местах имплантации метастаз, где они формировали внеклеточные ловушки, однако в местах имплантации не метастатических клеток они найдены не были [8].
В последние годы внеклеточные нейтрофильные ловушки интересны не только как фактор врожденного иммунитета, их также изучают с позиции участия в патогенезе различных заболеваний. Очевидно, что неконтролируемое избыточное или недостаточное формирование NETs может иметь серьезные последствия. Однако необходимо более точно определить их роль в механизмах развития различных заболеваний, поскольку это может открывать новые, более прогрессивные методы диагностики и лечения болезней.
Источники
1. V. Brinkmann, «Neutrophil Extracellular Traps in the Second Decade», J. Innate Immun., т. 10, вып. 5–6, сс. 414–421, 2018.
2. B. G. Yipp и P. Kubes, «NETosis: how vital is it?», Blood, т. 122, вып. 16, сс. 2784–2794, окт. 2013.
3. T. A. Fuchs, A. Brill, и D. D. Wagner, «Neutrophil Extracellular Trap (NET) Impact on Deep Vein Thrombosis», Arterioscler. Thromb. Vasc. Biol., т. 32, вып. 8, сс. 1777–1783, авг. 2012.
4. J. Geddings и N. Mackman, «New players in haemostasis and thrombosis», Thromb. Haemost., т. 111, вып. 04, сс. 570–574, 2014.
5. M. Dwyer и др., «Cystic fibrosis sputum DNA has NETosis characteristics and neutrophil extracellular trap release is regulated by macrophage migration-inhibitory factor», J. Innate Immun., т. 6, вып. 6, сс. 765–779, 2014.
6. V. Marcos и др., «Free DNA in cystic fibrosis airway fluids correlates with airflow obstruction», Mediators Inflamm., т. 2015, с. 408935, 2015.
7. S. B. Coffelt, M. D. Wellenstein, и K. E. de Visser, «Neutrophils in cancer: neutral no more», Nat. Rev. Cancer, т. 16, вып. 7, сс. 431–446, 2016.
8. Park J. et al. Cancer cells induce metastasis-supporting neutrophil extracellular DNA traps //Science translational medicine. – 2016. – Т. 8. – №. 361. – С. 361ra138-361ra138.
