Антиметаболиты

Для лекарственных препаратов, влияющих на иммунную систему, терминология зарубежных и отечественных источников разительно отличается. В данном посте мы рассмотрим иммуномодуляторные и иммуносупрессивные средства, которые способны подавлять реакции иммунного ответа. Очень часто этой темой пренебрегают в курсе фармакологии и затрагивают ее только лишь на старших курсах.
Чаще всего препараты этих групп применяют в лечении аутоиммунных заболеваний, таких как ревматоидный артрит, псориаз, рассеянный склероз, и при хронических воспалительных заболеваниях кишечника. Эти лекарственные средства непосредственно воздействуют на иммунную систему, и, таким образом, опосредованно оказывают антифлогистическое и анальгетическое действие.
Иммуносупрессивные препараты полностью подавляют деятельность иммунной системы. Поэтому важно помнить о риске развития оппортунистических инфекций во время и после терапии. Классическим примером применения данной группы препаратов являются реакции отторжения трансплантированных органов.
Иммуномодуляторы же способны влиять на иммунную систему, не вызывая подобных рисков. Иммуносупрессивные препараты в небольших концентрациях часто применяют в качестве иммуномодуляторов (например, метотрексат при ревматоидном артрите). Антиревматические препараты (disease-modifying anti-rheumatic drugs, DMARD) также относят к препаратам данной группы. Однажды мы уже рассказали вам о биофармацевтических препаратах, так называемых Biologicals. Часть этих препаратов, в свою очередь, обладает иммуномодуляторными свойствами. Дозировка и степень подавления иммунных реакций определяет, к какому классу препаратов относится то или иное лекарственное вещество — к иммуномодуляторам или иммуносупрессорам.
В данной серии постов мы разберем механизмы действия некоторых фармацевтических препаратов данной группы.
Всем нам известно, что при реакциях иммунного ответа главную роль берут на себя лимфоциты. Эти клетки начинают усиленно делиться, что предусматривает повышенный синтез нуклеиновых кислот. Другие же клетки организма обходятся переработкой нуклеотидов (например, по биохимическим путям типа salvage pathway). Антипролиферативные препараты как раз подавляют синтез новых нуклеотидов, что находит применение в трансплантологии и онкологии, а в низких дозировках — при аутоиммунных заболеваниях. Чаще всего под удар попадают не только те клетки, которые начинают усиленно делиться в момент иммунного ответа, но и те, что физиологически часто регенерируют:
- слизистая гастроинтестинального тракта (диарея и тошнота);
- мочеполовая система (риск развития инфекций);
- кровеносная система (постоянно делящиеся клетки костного мозга разрушаются, что является причиной развития лейкопении и анемии);
- эмбриональные клетки (данные препараты противопоказаны во время беременности и периода кормления грудью).
Также не рекомендуется назначать ингибиторы синтеза нуклеотидов при анемиях и острых инфекциях.
Антиметаболиты можно условно разделить на 3 группы:
- Аналоги фолатов (метотрексат, пеметрексед, ралитрексед);
- Аналоги пиримидинов (лефлуномид, цитарабин, азацитидин, капецитабин, децитабин, фторурацил, гемцитабин, тегафур);
- Аналоги пуринов (азатиоприн, кладибрин, клофарабин, флударабин, меркаптопурин, неларабин, пентостатин, тиогуанин, микофенолата мофетил)
Принадлежность к группе антиметаболитов подразумевает не только ошибочное встраивание молекул вместо самих нуклеотидов, но и нарушение их синтеза (рис. 1, 2).
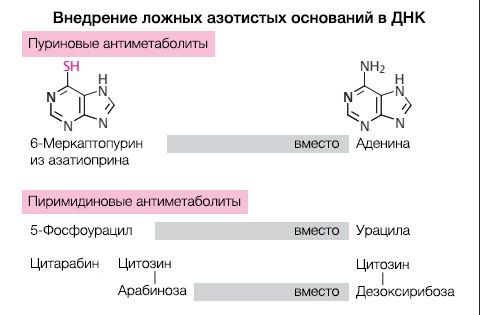
Рисунок 1.
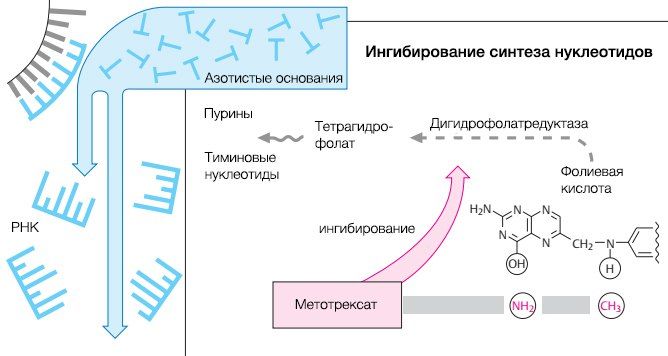
Рисунок 2.
Аналоги фолатов
Метотрексат является антагонистом фолиевой кислоты. Этот препарат может действовать в зависимости от дозировки как иммуномодулятор (терапия ревматоидного артрита и псориаза), или как цитостатик (лечение острой лимфатической лейкемии и неходжкинских лимфом). При дозировке 7,5–25 мг/нед. метотрексат способен ингибировать фермент с ужасающим названием — аминоимидазол карбоксамид рибонуклеотид трансформилазу (AICAR), тем самым подавляя синтез пуриновых нуклеотидов и метилирование ДНК, а также энергетический обмен, ингибируя аденозин-дезаминазу (рис. 3).
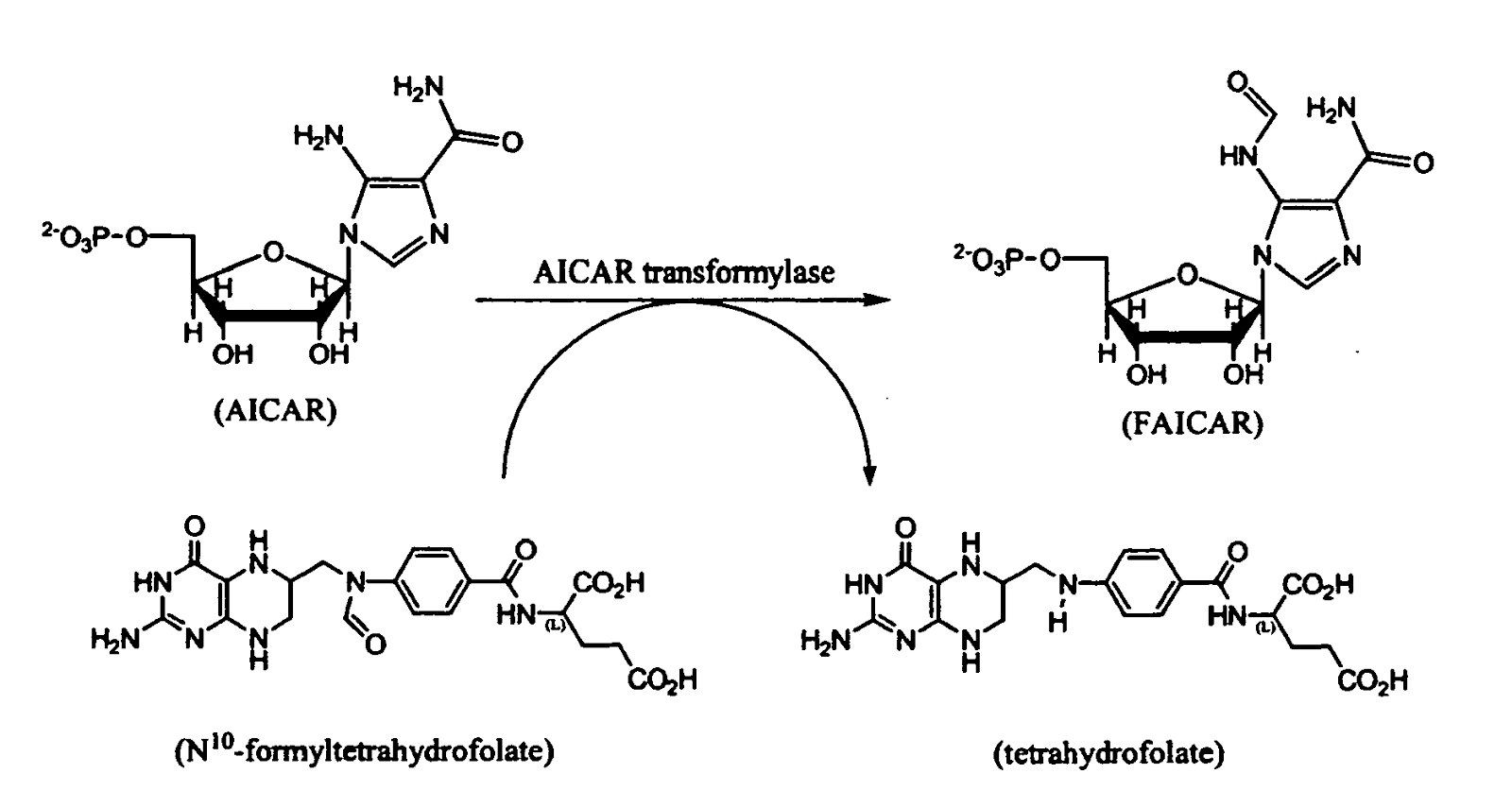
Рисунок 3.
При высоких дозировках метотрексат блокирует дигидрофолатредуктазу и тимидилатсинтазу, что обуславливает его цитостатические свойства. Превышение допустимых дозировок может привести к повреждениям ДНК и апоптозу клеток.
В целях достижения иммуномодуляторного действия (например, в рамках терапии ревматоидного артрита) метотрексат вводят в низкой дозировке один раз в неделю подкожно, внутримышечно или принимают в виде таблеток. Если же принимать препарат ежедневно по 1–3,5 мг, происходит разрушение костного мозга, что можно предотвратить, вводя препарат с недельными промежутками. После введения препарата через 1–2 дня рекомендуют принимать фолиевую кислоту. Если сделать это раньше, чем через день, эффективность действия метотрексата существенно снижается. При интоксикации метотрексатом вводят синтетический аналог тетрагидрофолиевой кислоты — фолиновую кислоту, являющуюся конечным продуктом обмена фолиевой кислоты. Метотрексат связывается с белками плазмы крови только лишь наполовину. Период его полувыведения составляет семь часов. Больше всего опасений вызывает его передозировка: он выводится из организма в неизмененном виде, что при почечной недостаточности у пожилых людей и гипогидратации может привести к его кумуляции. Поэтому ингибиторы циклооксигеназы (НПВС) рекомендуется принимать спустя сутки после введения метотрексата или за 12–36 часов до него. Логично предположить, что следует избегать одновременного приема метотрексата и другого ингибитора синтеза фолиевой кислоты — ко-тримоксазола (сульфаметоксазол + триметоприм). Салицилаты способны занимать место метотрексата на переносчике обоих групп лекарственных средств — альбумине, что является причиной возникновения серьезных побочных эффектов. Салицилаты также способны конкурировать с метотрексатом за анионный органический транспортный белок в почках, играющий роль в выведении лекарственных веществ из организма, что повышает риск его кумуляции.
При кумуляции метотрексат нарушает работу почек, печени и костного мозга. У 5 из 1000 больных он способен стимулировать развитие агранулоцитоза. У 2 пациентов из 1000 развивается фиброз легких. В низких дозировках метотрексат хорошо усваивается больными, и только лишь 15 % отказываются от его приема в течение первых пяти лет. В таких низких дозировках не происходит супрессии иммунной системы, что не влияет на повышенную заболеваемость инфекционными болезнями.
Метотрексат в низких дозировках можно использовать при аутоиммунных заболеваниях, в высоких — при опухолевых. Если рассматривать метотрексат как цитостатический препарат, то его относят к группе антиметаболитов. По своей структуре он очень напоминает фолиевую кислоту, поэтому, как было описано ранее, в высоких дозировках он почти необратимо связывается с дигидрофолатредуктазой, препятствуя передвижению фермента в клетке (рис. 4).
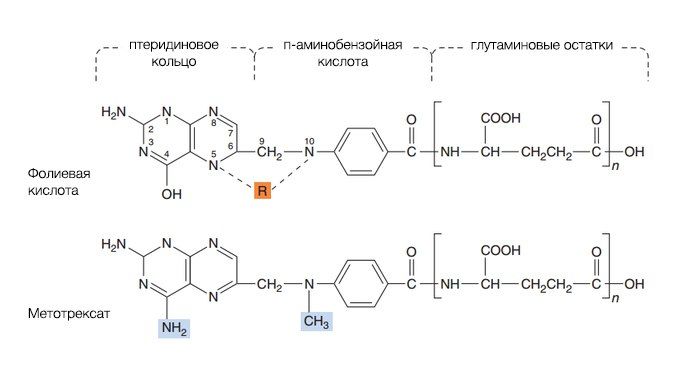
Рисунок 4.
Метотрексат также связывает в клетке молекулы глутамата, образуя метотрексатполиглутамат, который из-за своей структуры не способен покинуть клетку, накапливается и, таким образом, оказывает цитотоксический эффект. Следует отметить, что все эти процессы происходят в S-фазу клеточного цикла, из-за чего антиметаболиты относятся к фазоспецифическим препаратам (в отличие от других групп цитотоксических препаратов).
Метотрексат используется также в рамках так называемой «терапии спасения» (rescue therapy) злокачественных опухолей в комбинации с антидотом — фолинатом кальция (N(5)-формил-тетрагидрофолиевая кислота, лейковорин), что снижает его токсичность по отношению к здоровым клеткам. Цитостатическое действие метотрексата находит применение в терапии остеосарком, острой лимфобластической лейкемии у детей (в данном случае при наличии осложнений со стороны ЦНС препарат вводят с помощью иглы в субарахноидальное пространство), при карциноме хориона или молочной железы, неходжкинских лимфом. В качестве иммуносупрессивного средства метотрексат используется в терапии не только ревматоидного артрита, но и болезни Крона, при псориазе, дерматомиозите и при ювенильном идиопатическом артрите.
Пеметрексед и ралтитрексид являются новыми аналогами метотрексата, ингибирующими тимидилат-синтазу, дегидрофолатрезуртазу и глицин-рибонуклеотид-формилтрансферазу, что дает возможность применять эти препараты в терапии карцином мезотелия, наследственного неполипозного рака толстой кишки, на поздних стадиях мелкоклеточного рака легких.
Аналоги пиримидинов
Лефлуномид (Arava) воздействует на активированные Т-клетки, ингибируя дигидрооротат-дегидрогеназу митохондрий. Как следствие, нарушается синтез уридинмонофосфата, предшественника пиримидиновых оснований. Лефлуномид, так же, как сульфасалазин и метотрексат, применяется в лечении ревматоидного артрита. Его побочные эффекты схожи: он может вызывать аллергические реакции на коже, провоцировать диарею и алопецию. Метаболизм этого лекарственного вещества в кишечнике связан с энтерогепатической системой, в русле которой лефлуномид может циркулировать более 10–15 дней, что может быть сопряжено с его аккумуляцией в печени и токсическим влиянием на нее. Метаболиты лефлуномида (главный — М1 и второстепенные, из которых в крови можно количественно определить только 4-трифторметилаланин, ТФМА) задерживаются в организме до 2 лет, поэтому для контроля выведения препарата существует следующая схема: прием холестирамина по 8 г 3 раза в день в течение 11 дней (необязательно принимать холестирамин строго 11 дней подряд, если нет необходимости быстрого снижения уровня М1 в плазме).
К пиримидиновым антиметаболитам также относят модифицированные нуклеозиды, которые сперва фосфорилируются в клетке до соответствующих нуклеотидов.
Цитарабин и гемцитабин встраиваются непосредственно в структуру ДНК в процессе ее синтеза, что приводит к обрыву цепи. Фторуридин-монофосфат является ингибитором тимидилат-синтазы и, таким образом, синтеза пиримидиновых нуклеотидов. Трифосфат фторуридина также способен встраиваться непосредственно в саму ДНК. Тегафур и капецитабин являются предшественниками 5-фторурацила, тоже пиримидинового антиметаболита. Терапия фторурацилом в комбинации с фолиевой кислотой позволяет усилить его эффект путем ингибирования синтазы тимидилата. 5-фторурацил можно вводить только парентерально, в то время как тегафур и капецитабин доступны и в таблетированной форме. Превращение в 5-фторурацил происходит под действием тимидинфосфорилазы (глиостатин, тромбоцитарный фактор роста эндотелия) клеток опухоли. Данные лекарственные вещества в настоящее время больше всего применяются в терапии колоректальных карцином, и, кроме того, при раке желудка и молочной железы. Часто используются комбинации 5-фторурацила с фолиевой кислотой и иринотеканом (режим FOLFIRI) или оксалиплатином (режим FOLFOX). Последнее сочетание отличается особо сильными побочными эффектами.
Антиметаболиты пиримидиновых оснований вызывают депрессию костного мозга, нарушение структур слизистой (стоматит, мукозит, диарея), холинергический синдром (диарея). В комбинации FOLFIRI c применением 5-фторурацила в форме капецитабина самым частым побочным эффектом является развитие ладонно-подошвенной эритродизестезии (hand-foot-syndrome, HFS). Как уже было отмечено ранее, гемцитабин способен встраиваться непосредственно в структуру ДНК, что позволяет его структура — дифтордезоксицитидин. Этот лекарственный препарат в настоящее время используется при онкологических заболеваниях поджелудочной железы и мочевого пузыря. Цитарабин же является цитозин-арабинозидом по своей структуре, что находит применение в терапии острой и хронических миеломных лимфом и при неходжкинских лимфомах (рис. 5).
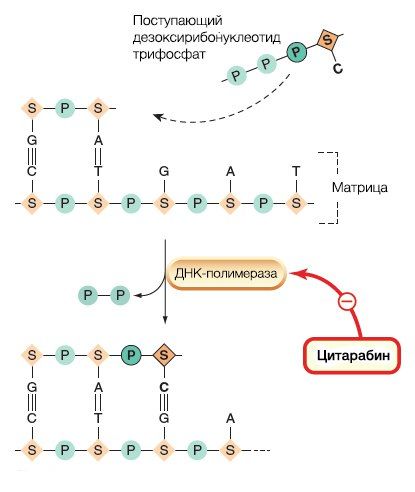
Рисунок 5.
Аналоги пуринов
Азатиоприн (Imurek) в печени метаболизируется до 6-меркаптопурина, который, в свою очередь, модифицируется до 6-тиогуанин-нуклеотида и 6-тиоинозин-монофосфата. Как ясно из названия, эти нуклеотиды способны подавлять деятельность многих ферментов, участвующих в синтезе пуринов (ИМФ-дегидрогеназа, аденилосукцинат-синтетаза). Подавляя синтез пуринов в Т- и В-лимфоцитах, препараты данной группы ингибируют сам иммунный ответ. Помимо лечения ревматоидного артрита и болезни Крона, азатиоприн применяют при отторжении трансплантированных органов. Однако стоит учитывать, что до наступления действия препарата могут пройти месяцы. Все побочные эффекты азатиоприна связаны с ингибированием пролиферации других клеток, вследствие чего развиваются аллергические реакции кожи, панкреатит, язвы и нарушается работа костного мозга. При одновременном приеме аллопуринола следует снизить дозировку азатиоприна на 75 %, так как аллопуринол является ингибитором ксантиноксидазы, участвующей в расщеплении 6-меркаптопурина. Генетический полиморфизм также обуславливает абсорбцию, распределение, биотрансформацию и выведение этого препарата. Вам уже, наверное, известно из курса общей фармакологии, что люди делятся на типы с низкой («slow metabolizers») и высокой скоростью метаболизма («normal metabolizers»). При медленной работе биотрансформирующих ферментов концентрация препарата в неизмененном виде в плазме крови увеличивается, что можно наблюдать на примере азатиоприна и меркаптопурина. Оба эти вещества метаболизируются в организме до метилтиопуринов с помощью фермента тиопуринметилтрансферазы (TMPT, thiopurine methyltransferas). 10 % пациентов являются носителем гена ТМРТ со сниженной активностью, а в 1 % случаев этот фермент вовсе находится в неактивном состоянии. У таких пациентов пурины не метилируются, что увеличивает концентрацию лекарственного вещества в плазме крови и усложняет его выведение. В данном случае риск токсического повреждения костного мозга особенно велик. Во избежание таких эффектов, активность ТМРТ сперва определяется в лаборатории и в случае наличия у пациента дефектного гена концентрация азатиоприна снижается на 90 % процентов. Интересный факт: данный пример генетического полиморфизма был описан именно на примере меркаптопурина и азатиоприна (рис. 6).
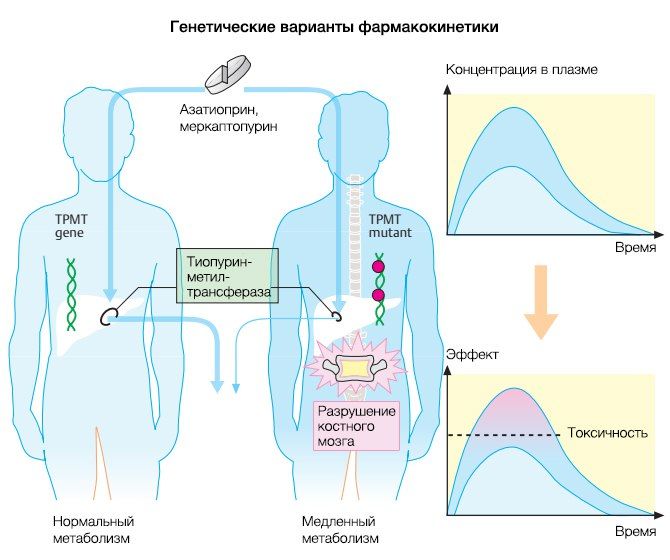
Рисунок 6.
Микофенолат способен ингибировать инозинмонофосфат-дегидрогеназу — ключевой фермент синтеза пуриновых нуклеотидов. Т- и В-лимфоциты особенно сильно зависят от деятельности этого фермента, поскольку, в отличие от других клеток, они лишены запасных путей для синтеза пуриновых азотистых оснований. Применяют данный препарат в основном в трансплантологии. Антациды, содержащие соединения магния и алюминия, которые иногда применяют в лечении изжоги и при болях в желудке, препятствуют всасыванию микофенолата в кишечнике. Микофеноловая кислота образуется из предшественника микофенолат мофетила (торговое название пролекарства — CellCept).
Меркаптопурин и тиогуанин также являются пуриновыми антиметаболитами. Эти вещества способны ингибировать образование АМФ и ГМФ из инозинмонофосфата.
Пентостатин ингибирует аденозин-дезаминазу, рибонуклеотид-редуктазу и, тем самым, сам синтез ДНК.
Кладрибин является ингибитором рибонуклеотид-редуктазы, а флударабин — ДНК-полимеразы. Все препараты данной группы нашли свое применение при различных заболеваниях крови и кроветворных органов.
Источники:
- Lullmann H. et al. Color atlas of pharmacology. – Thieme,, 2005.
- Herdegen T. et al. Kurzlehrbuch Pharmakologie und Toxikologie. – Georg Thieme Verlag, 2013.
- Rang H. P. et al. Rang & Dale's Pharmacology E-Book: with STUDENT CONSULT Online Access. – Elsevier Health Sciences, 2014.
