Особенности течения и пренатального лечения миеломенингоцеле
Spina bifida — врожденный порок развития, связанный с нарушением формирования эмбриональной нервной трубки или смыкания ее краев и сопровождающийся серьезными неврологическими нарушениями, такими как паралич или нарушение функции органов малого таза.
По распространенности среди всех аномалий развития занимает второе место после врожденных пороков сердца, а самым частым вариантом дефекта нервной трубки является миеломенингоцеле. Новые методы лечения позволяют улучшить прогноз и качество жизни детей с данным пороком развития. Одним из таких методов является внутриутробное хирургическое закрытие дефекта.
Патогенез
В норме заращение нервной трубки происходит на 3–4 неделе эмбрионального развития. В формировании нервной трубки выделяют два этапа: первичная нейруляция и вторичная. Первичная нейруляция — процесс сращения краев нервной пластинки, вторичная нейруляция — формирование ее нижних отделов.
Рисунок 1 | Схема формирования нервной трубки
Воздействие тератогенных факторов, недостаток фолиевой кислоты или хромосомные аномалии могут нарушать процесс первичной и вторичной нейруляции, что приводит к образованию различных вариантов spina bifida: бессимптомной формы, связанной с недостаточным сближением позвонков (spina bifida occulta), менингоцеле и миеломенингоцеле (spina bifida cystica).
Рисунок 2 | Классификация дефектов нервной трубки
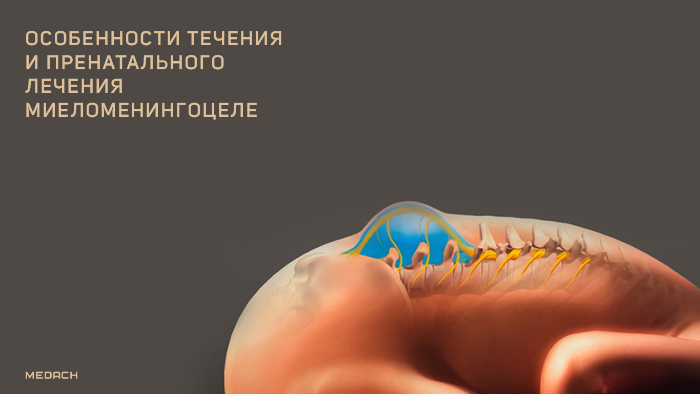
Миеломенингоцеле является наиболее тяжелой формой заболевания и сопровождается выходом в грыжевой мешок мозгового вещества и мозговых оболочек. Дефект может располагаться в любом месте вдоль оси позвоночника, но чаще всего находится в поясничном отделе. Миеломенингоцеле также связано с неправильным развитием краниального конца нервной трубки, что приводит к нескольким характерным аномалиям ЦНС.
Для мальформации Киари III типа характерна гипоплазия мозжечка и различная степень каудального смещения нижних отделов ствола головного мозга в шейный отдел позвоночного канала через большое затылочное отверстие. Эта деформация препятствует движению и абсорбции спинномозговой жидкости и вызывает гидроцефалию, которая встречается у более чем 90 % младенцев с миеломенингоцеле. Также у детей наблюдаются психоневрологические нарушения, паралич нижних конечностей, нейрогенная дисфункция мочевого пузыря и кишечника, сопровождающаяся недержанием.
Рисунок 3 | Новорожденный с миеломенингоцеле
На ранних сроках гестации при гистологическом исследовании тканей спинного мозга из области незавершенной нейруляции, изменения, как правило, не выявляются. Патологические изменения, такие как эрозии, кровоизлияния, воспаление или дистрофия возникают с увеличением срока гестации. Причиной может быть токсическое действие веществ, растворенных в амниотической жидкости, кроме того, содержимое грыжевого мешка может значительно повреждаться во время родов.
Таким образом, в патогенезе неврологических нарушений при миеломенингоцеле можно выделить два основных фактора: незавершенная нейруляция и повреждение тканей вследствие травм, воспаления и дегенеративных изменений (так называемый «двойной удар»). На основании этих данных можно сделать вывод, что заболевание прогрессирует во время беременности.
Преимуществом пренатального лечения является предупреждение такого прогрессирования патологии, а значит, уменьшение негативного влияния на ЦНС «двойного удара» и улучшение прогноза. Тщательное пренатальное обследование и раннее закрытие дефекта способствуют улучшению качества жизни детей и уменьшению частоты осложнений.
Сущность оперативного лечения
Операцию рекомендуется проводить между 19 и 25 неделями гестации. Беременная женщина, вынашивающая ребенка с диагнозом миеломенингоцеле, должна пройти ряд исследований для оценки возможности оперативного вмешательства:
- акушерское обследование;
- УЗИ плода с целью определения функции нижних конечностей (в т. ч. деформации стопы), а также уровня, на котором расположен дефект позвоночника;
- генетический скрининг;
- эхокардиография плода с целью выявления пороков сердца;
- МРТ с целью определения мальформации Киари II типа, грыжи заднего мозга и других аномалий развития головного мозга, в том числе гидроцефалии.
Критерии для проведения операции:
— возраст матери старше 18 лет;
— срок гестации между 19 и 25 неделями;
— нормальный кариотип плода;
— расположение грыжевого мешка в районе S1 и выше;
— подтвержденное с помощью УЗИ и МРТ выпячивание заднего мозга.
Противопоказания:
— многоплодная беременность;
— наличие других аномалий развития совместно со spina bifida;
— фетальный кифоз 30 градусов и более;
— предлежание плаценты;
— мягкая и/или короткая шейка матки (< 20 мм по результатам УЗИ);
— спонтанные ранние роды в анамнезе (первые роды в сроке < 37 недель);
— резус-конфликт;
— гестационный сахарный диабет;
— ожирение с ИМТ 35 и более;
— ВИЧ, гепатит В, гепатит С;
— аномалии развития матки;
— другие серьезные заболевания матери;
— психосоциальные ограничения;
— ограничение передвижения.
Соблюдение данных критериев позволяет снизить негативные последствия операции как для матери, так и для плода.
Операция проводится в два этапа:
- Нижняя поперечная лапаротомия, вертикальная гистеротомия с наложением скоб;
- Закрытие дефекта у плода.
Рисунок 4 | Методика проведения операции
Операция проводится под общим наркозом, обеспечивающим одновременное обезболивание матери и плода. Киста иссекается, дефект послойно ушивается и закрывается с помощью сшивания боковых кожных лоскутов, что формирует0 защиту развивающегося спинного мозга.
Рисунок 5 | Техника послойного ушивания дефекта
К послеоперационным осложнениям можно отнести хориоамнионит, сверхранние роды (до 28 недель), маловодие вследствие потери амниотической жидкости. Учитывая риск данных осложнений, требуется контроль состояния матери и плода.
Заключение
Принимая во внимание тот факт, что патологические изменения в спинном мозге у пациентов с миеломенингоцеле нарастают с увеличением срока гестации, пренатальная коррекция данного порока развития будет оптимальным вариантом, позволяющим достоверно снизить риск развития паралича, дисфункции мочевого пузыря и кишечника и других расстройств, следовательно, улучшить качество жизни пациентов.
Также вы можете ознакомиться с переводом инфографики из журнала Nature Reviews Disease Primers → http://medach.pro/post/1608
Источники:
- Spina Bifida [Электронный ресурс] / Mark R Foster, MD, PhD, FACS et al. — Электрон. журн. — 2018. — Режим доступа: https://emedicine.medscape.com/article/311113-overview, свободный
- N Scott Adzick, Leslie N Sutton, Timothy M Crombleholme, Alan W Flake. Successful fetal surgery for spina bifida// The Lancet, Vol 352, 1998
- Andrew J. Copp, N. Scott Adzick, Lyn S. Chitty, Jack M. Fletcher, Grayson N. Holmbeck, Gary M. Shaw. Spina bifida // Nature Reviews Disease Primers, Vol.1, 2015
- N.S. Adzick. Fetal surgery for spina bifida: Past, present, future. // Seminars in Pediatric Surgery Vol.22, 2013
- А.С. Иова, Ю.А. Гармашов, Е.Ю. Крюков, Д.А. Иова. Возможности и перспективы пренатальной нейрохирургии (Нейрохирургии плода). // Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова. Том 7, №2, 2015
- Luc Joyeux,Enrico Danzer, Alan W Flake, Jan Deprest. Fetal surgery for spina bifda aperta //Child Fetal Neonatal Ed, 2018
