Белки суперсемейства TRIM и внутриклеточный иммунитет
Весь наш иммунитет можно условно разделить на гуморальный (основное звено — В-клетки) и клеточный (Т-клетки), вместе они обеспечивают защиту от различных инфекционных агентов. Долгое время считалось, что иммунокомпетентные клетки (ИКК) способны нейтрализовать микроб только вне клетки, если инфекция поразила клетку — тогда остается лишь вызвать ее апоптоз.
Однако в нашем организме существует целая система протеинов, обеспечивающих внутриклеточную защиту от инфекций, которые способны нейтрализовать чужеродный агент, не причиняя вреда самой клетке. На сегодняшний момент известно, что данная группа белков составляет полноценное суперсемейство, которое выполняет самые разные функции.
Белки, содержащие трехсторонний мотив (англ. tripartite motif-containing proteins — TRIMs) известны с конца прошлого столетия. Тогда ученые обнаружили в нуклеоплазме особую фракцию белков с необычным строением (а именно — структура «цинкового пальца» в одном из доменов). Исследователи предположили, что данные белки как-то связаны с противовирусным иммунитетом, а также с противоопухолевой защитой [1].
Сегодня известно, что данная группа белков имеется не только у человека, но и у всех млекопитающих, причем их количество и структура варьирует. Так, у людей имеется примерно 60–70 различных TRIMs, выполняющих множество функций. Примечательно, что белки данного семейства обнаруживаются практически во всех клетках организма, что не может не указывать на определенную эволюционную закономерность [2, 3].
Суперсемейство TRIMs относят к факторам врожденного иммунитета. Под влиянием интерферона 1 и 2 типов (ИФН-α, -β и ИФН-γ соответственно) происходит индукция этих протеинов, они начинают в ускоренном темпе синтезироваться в клетках, чтобы обеспечить затем адекватный ответ на какой-либо чужеродный объект [4].
Белки данного суперсемейства имеют характерное строение. На N-конце первым стоит т. н. RBBCC-мотив (состоящий из трех частей – R, BB и CC) – характерное отличие данных протеинов, которое легло в название — содержащие трехсторонний мотив.
Сам трехсторонний мотив (RBBCC) состоит из высококонсервативных цинксвязываюших RING-домена (R) и одного или двух B-Box домена (BB), за которым следуют CC-домен (англ.coiled-coil — спиральная катушка). Первые два — общие для всех TRIMs, они участвуют в убиквитинировании (посттранслянционная модификация протеинов, см. ниже), а также предполагается их участие в белок-белковых взаимодействиях. СС-домен также участвует в межмолекулярных взаимодействиях, благодаря чему белки суперсемейства способны формировать т. н. ядерные тельца, что необходимо для регуляции клеточного цикла [5].
Крайне важной является способность TRIMs осуществлять убиквитинирование — посттрансляционную модификацию белков, которая способна привести как к усилению свойств белка, так и к полной их нейтрализации посредством присоединения небольшой молекулы — убиквитина.
Обеспечивают данный процесс три убиквитин-лигазы (Е1, Е2 и Е3), в роли которых может выступить любой белок, имеющий RING-домен (и в том числе — белки семейства TRIM, которые обладают Е3-лигазной активностью); ниже описано, как именно данное свойство позволяет некоторым TRIM выполнять свои функции [5].
Таким образом, три важнейших центра на N-конце молекулы — RING-домен, B-box и СС — и будут обеспечивать основные функции протеинов. Но не менее важен и С-концевой участок, который может содержать один (или несколько) из 10 типичных мотивов — именно строение С-конца легло в основу классификации суперсемейства на подгруппы (Рис. 1). Например, COS-домен опосредует связывание с микротрубочками в цитозоле, что помогает белкам обеспечивать противовирусную защиту [4].
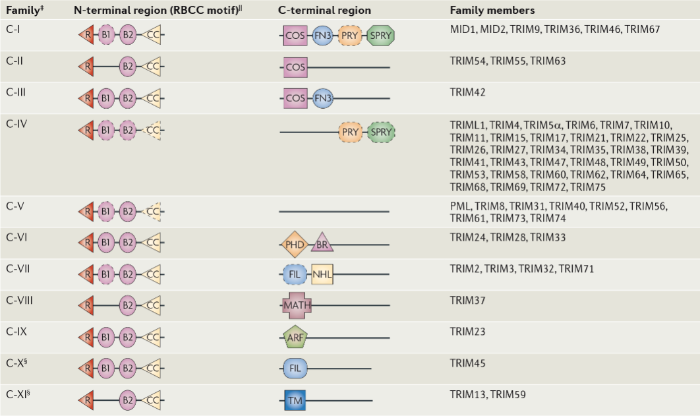 Рисунок 1. Схематическое изображение структур белков различных семейств TRIM.
Рисунок 1. Схематическое изображение структур белков различных семейств TRIM.
Пожалуй, важнейшим мотивом C-конца молекулы можно назвать PRYSPRY домен, состоящий из двух участков PRY (≈ 61 аминокислоты) и SPRY (≈ 140 аминокислот). По отдельности их можно обнаружить в клетках растений и даже грибов, но только у позвоночных они формируют особый PRYSPRY-домен, который участвует в процессах связывания инфекционного агента, а также этот участок является высокоспецифичным рецептором для молекулы IgG — этот факт позволил установить участие белка TRIM21 в обеспечении противовирусной защиты (см. ниже) [4, 6].
Существуют и другие С-концевые домены, например FN3 — фибронектин 3 типа — может содержать участки связывания с ДНК; MATH (англ. merin- and tumor-necrosis factor) необходим для регуляции клеточного цикла и предотвращения избыточной пролиферации [4]. О белках данного семейства мы постепенно узнаём все больше, а потому и представления о С-концевых функциональных участках наверняка будут видоизменятся.
Современная медицина рассматривает белки суперсемейства TRIM как одну из возможных точек воздействия на иммунную систему; вполне можно ожидать, что использование этих протеинов может стать эффективным терапевтическим средством. Основная же роль этих белков — в обеспечении внутриклеточной противовирусной защиты (Рис. 2). На каждом из этапов репликации вируса существуют белки, которые способны предотвращать переход вирусной частицы на следующий этап, а также TRIMs, выполняющие регуляторную функцию — индукцию или ингибирование эффекторных TRIMs. На данный момент не совсем ясно, в чем заключается физиологическая роль ингибирования белков, нейтрализующих вирусную частицу.
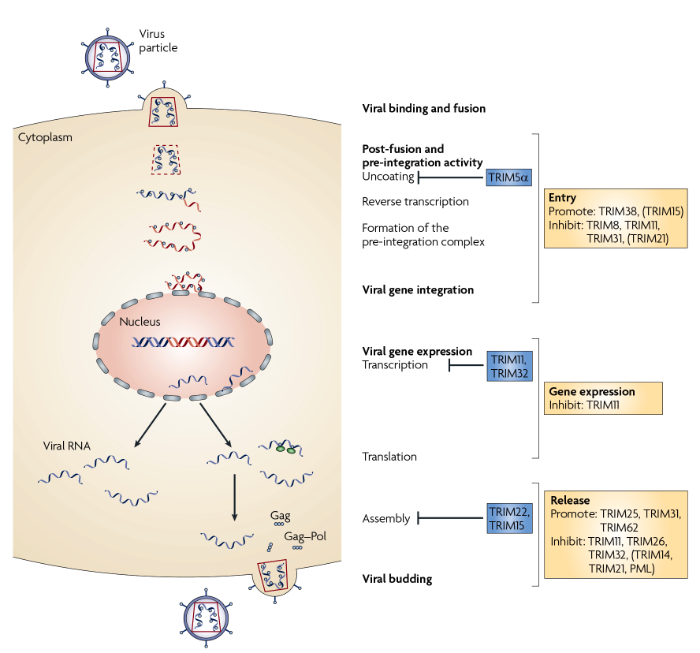 Рисунок 2. Роль белков TRIM при ВИЧ-инфекции у человека и мыши.
Рисунок 2. Роль белков TRIM при ВИЧ-инфекции у человека и мыши.
Как можно увидеть, различные протеины суперсемейства имеют свою специализацию. Ниже описаны наиболее изученные белки данной группы, которые представляют наибольший интерес с терапевтической точки зрения.
TRIM 21
Данный внутриклеточный рецептор пользуется особым отношением благодаря наличию домена PRYSPRY, который имеет высокое сродство к иммуноглобулину G. Синтез TRIM21 активируется интерфероном-α, далее своим PRYSPRY-участком белок связывается с Fc-фрагментом иммуноглобулина, который несет вирусный антиген [6]. Как уже было сказано выше, RING-домен обладает Е3-лигазной активностью. Запуская процесс убиквитинирования, TMIR21 активирует внутриклеточную протеасому — комплекс белков, обладающих протеолитической активностью. Не индуцируя процесс апоптоза, протеасома разрушает антиген без особого вреда для самой клетки. Важно отметить: деградация вируса была инициирована иммуноглобулинами, т. е. гуморальный иммунитет обеспечивает не только внеклеточную защиту, — наши клетки способны бороться с инфекцией и в цитозоле.
Однако TRIM21 обладает еще одним важным свойством — он способен ингибировать фактор транскрипции NF-κB (ядерный фактор «каппа-би», англ. nuclear factor kappa-light-chain-enhancer of activated B cells). NF-κB опосредует клеточную пролиферацию, также была показана корреляция между активностью данного фактора и риском развития онкологических заболеваний [7]. TRIM21 способен блокировать этот фактор транскрипции, предотвращая бесконтрольное деление клеток.
Кроме того, противоопухолевая защита TRIM21 направлена также на активацию белка p-27, который не дает клетке войти в S-фазу; а также на супрессию белка LFG (англ. Lifeguard). LFG ингибирует процесс апоптоза в раковой клетке и не дает его вызвать интерлейкинам, таким образом провоцируя развитие опухолевых заболеваний [8].
TRIM 5-α
Все белки семейства TRIM участвуют в противовирусной защите, однако TRIM5-α более всего известен благодаря свой антиретровирусной активности, в том числе, защите клеток от ВИЧ-инфекции [2, 9, 10]. Хотя точный механизм действия этих белков неизвестен (даже их точную локализацию в цитозоле определить на данный момент сложно), была показана корреляция между синтезом этого протеина и блокированием пролиферации вируса иммунодефицита, причем уже после попадания последнего в клетку.
TRIM5-α — видоспецифичный белок, который будет иметь небольшие отличия у человека и обезьяны. Известно, что TRIM5-α обезьян оказывает гораздо более сильный противовирусный эффект, чем наш человеческий аналог из-за несколько другой аминокислотной последовательности [2]. Примечательно, что у обезьян была выявлена способность TRIM5-α бороться и с вирусом иммунодефицита человека (ВИЧ), и с вирусом иммунодефицита обезьян (ВИО), тогда как человеческий пептид оказывает защиту только от ВИЧ, причем куда слабее.
Причина данного феномена — в наборе аминокислот. Линейная последовательность TRIM5-α у обезьян и человека отличается по аминокислоте в 332 положении: у человека на этом месте стоит аргинин, у обезьян — пролин [11]. Выдвинув гипотезу, что именно в этом кроется намного более эффективная противовирусная активность обезьяньего TRIM5-α, группа ученых заменила в человеческом протеине арг332 на пролин. Полученный мутантный TRIM5-α показал гораздо большую эффективность в борьбе с ВИЧ, связываясь с капсидом вируса с последующей нейтрализацией последнего [12]. Конечно, до клинических исследований подобного метода как способа лечения или профилактики ВИЧ-инфекции еще очень далеко, однако сам факт того, что существует способ помочь нашим клеткам противостоять подобному вирусу, не может не обнадежить.
TRIM 22
Еще одним белком семейства TRIM, который способен оказывать защиту против ВИЧ, является протеин TRIM22. Еще в конце прошлого столетия появились исследования, показывающие, что лечение интерфероном 1 типа (ИФН- α и –β) способны снижать пролиферацию вируса иммунодефицита человека и обезьян [13, 14]. Этот феномен связывают с активацией интерфероном синтеза белков TRIM, в том числе — TRIM22, который является ключевым медиатором в защите против ВИЧ. Благодаря своей Е3-лигазной активности, протеин обладает способностью ингибировать пролиферацию вируса, разрушая Gag-белки (структурные компоненты вируса) [15].
Пептид TRIM22 связан с еще одним инфекционным заболеванием – гепатитом В, только в этом случае он проявлял себя как ингибитор транскрипции вируса [16]. Пока что исследование проводилось только на культуре клеток и на мышах, однако в перспективе использование TRIM22 как супрессора транскрипции вируса гепатита В способно стать эффективным методом лечения и профилактики данного заболевания.
Существует и множество других белков этого суперсемейства, которые также оказывают противовирусную и противоопухолевую защиту. Важно подчеркнуть, что эти белки осуществляют именно внутриклеточную защиту организма от инфекционных агентов. Изучение пептидов, содержащих трехсторонний мотив — перспективное и быстроразвивающееся направление иммунологии и клеточной биологии, которое вскоре может стать дополнением к уже известным способам лечения многих заболеваний.
Источники:
- B. A. Reddy, L. D. Etkin, and P. S. Freemont, “Protein sequence motifs,” Trends Biochem. Sci., vol. 17, no. September, pp. 344–345, 1992.
- J. P. S. and A. O. Finlay W McNab, Ricardo Rajsbaum, “Tripartite-motif proteins and innate immune regulation,” Curr. Opin. Immunol., vol. 23, no. 1, pp. 46–56, 2011.
- L. C. James, A. H. Keeble, Z. Khan, D. A. Rhodes, and J. Trowsdale, “Structural basis for PRYSPRY-mediated tripartite motif ( TRIM ) protein function,” PNAS, pp. 2–7, 2007.
- K. Ozato, D. M. Shin, T. H. Chang, and H. C. Morse, “TRIM family proteins and their emerging roles in innate immunity,” Nat. Rev. Immunol., vol. 8, no. 11, pp. 849–860, 2008.
- G. Meroni and G. Diez-Roux, “TRIM/RBCC, a novel class of ‘single protein RING finger’ E3 ubiquitin ligases,” BioEssays, vol. 27, no. 11, pp. 1147–1157, 2005.
- D. L. Mallery, W. A. McEwan, S. R. Bidgood, G. J. Towers, C. M. Johnson, and L. C. James, “Antibodies mediate intracellular immunity through tripartite motif-containing 21 (TRIM21),” Proc. Natl. Acad. Sci., vol. 107, no. 46, pp. 19985–19990, 2010.
- S. Huang, C. A. Pettaway, H. Uehara, C. D. Bucana, and I. J. Fidler, “Blockade of NF- k B activity in human prostate cancer cells is associated with suppression of angiogenesis , invasion , and metastasis,” vol. 1, pp. 4188–4197, 2001.
- J. Müller, V. Maurer, K. Reimers, P. M. Vogt, and V. Bucan, “TRIM21, a negative modulator of LFG in breast carcinoma MDA-MB-231 cells in vitro,” Int. J. Oncol., vol. 47, no. 5, pp. 1634–1646, 2015.
- P. A. & J. S. Matthew Stremlau, Christopher M. Owens, Michel J. Perron, Michael Kiessling, “The cytoplasmic body component TRIM5a restricts HIV-1 infection in Old World monkeys,” Nature, vol. 427, no. February, pp. 848–853, 2004.
- X. Zhang et al., “Inhibitory effect of human TRIM5α on HIV-1 production,” Microbes Infect., vol. 12, no. 10, pp. 768–777, 2010.
- S. L. Sawyer, L. I. Wu, M. Emerman, and H. S. Malik, “Positive selection of primate TRIM5 identifies a critical species-specific retroviral restriction domain,” Proc. Natl. Acad. Sci., vol. 102, no. 8, pp. 2832–2837, 2005.
- Y. Li, X. Li, M. Stremlau, M. Lee, and J. Sodroski, “Removal of Arginine 332 Allows Human TRIM5 To Bind Human Immunodeficiency Virus Capsids and To Restrict Infection,” J. Virol., vol. 80, no. 14, pp. 6738–6744, 2006.
- M. B. Agy, R. L. Acker, C. H. Sherbert, and M. G. Katze, “Interferon Treatment Inhibits Virus Replication in HIV-1- and SIV-Infected CD4+ T-Cell Lines by Distinct Mechanisms: Evidence for Decreased Stability and Aberrant Processing of HIV-1 Proteins,” Virology, vol. 214, no. 2, pp. 379–386, 1995.
- L. Baca-Regen, N. Heinzinger, M. Stevenson, and H. E. Gendelman, “Alpha interferon-induced antiretroviral activities: restriction of viral nucleic acid synthesis and progeny virion production in human immunodeficiency virus type 1-infected monocytes,” J. Virol., vol. 68, no. 11, pp. 7559–7565, 1994.
- S. D. Barr, J. R. Smiley, and F. D. Bushman, “The interferon response inhibits HIV particle production by induction of TRIM22,” PLoS Pathog., vol. 4, no. 2, pp. 1–12, 2008.
- B. Gao, Z. Duan, W. Xu, and S. Xiong, “Tripartite motif-containing 22 inhibits the activity of hepatitis B virus core promoter, which is dependent on nuclear-located RING domain,” Hepatology, vol. 50, no. 2, pp. 424–433, 2009.
