Раскрытие принципов действия глюкокортикоидов при ревматоидном артрите.
В новом исследовании на мышах с направленной делецией рецепторов глюкокортикоидов были выделены клетки, через которые осуществляется противоартритное действие глюкокортикоидов. Сюрпризом стало то, что случае наблюдения за артритом, вызванным переливанием крови, кортикостероиды воздействуют на стромальные, а не на иммунные клетки.
Несмотря на то, что препараты на основе кортикостероидов используются как важнейшая часть терапии против ревматоидного артрита (РА) уже на протяжении почти 70 лет, только сейчас становятся прозрачными механизмы их воздействия. Маша Коэнен (Mascha Koenen) из Института сравнительной молекулярной эндокринологии при Ульмском Университете в Германии (Institute for Comparative Molecular Endocrinology, University of Ulm, Ulm, Germany) и ее коллеги в своей новой работе использовали разнообразный арсенал in vivo методик для определения того, как глюкокортикоиды снижают воспаление в суставах на модели артрита вызванного переливанием крови (Serum transfer induced arthritis model - STIA). Для получения мышей с делецией рецепторов к глюкокортикостероидам (ГКС), как в гематопоэтическом, так и в стромальном компартменте, были необходимы несколько компонентов. Во-первых мышей подвергли облучению для гибели иммунных клеток, а затем с помощью донорских клеток костный мозг был репопулирован, что позволило получить так называемые костномозговые химеры. Затем с помощью тамоксифен-индуцируемой системы рекомбинации Cre-lox (tamoxifen- inducible Cre–lox system) была спровоцирована делеция в гене NR3C1, отвечающем за кодирование глюкокортикоидных рецепторов.
Отсутствие рецепторов к ГКС в гемопоэтических клетках не сказалось на способности дексаметазона снижать отечность и подавлять воспаление в суставах, а вот отсутствие таких рецепторов в клетках стромы привело к нивелированию эффекта дексаметазона на воспалительный процесс.
Основой этого исследования стала работа по созданию альтернативной модели суставного воспаления на мышах, названной адъювантным артритом (adjuvant- induced arthritis -AIA). При этом у мышей с AIA противовоспалительный эффект ГКС зависел от наличия рецепторов к ГКС у Т-клеток, в особенности у Т-хелперов 17. В модели AIA никакого вклада от стромальных рецепторов к ГКС не наблюдалось. Данные, полученные от других моделей воспаления, свидетельствуют о ключевом влиянии на работу кортикостероидов рецепторов к ГКС у макрофагов, что еще более усложняет понимание этих процессов. Это свидетельствует о том, что хотя терапевтические эффекты ГКС в разных моделях воспаления схожи, они обеспечиваются разными типами клеток. Основным вопросом становится применение этих моделей на мышах к конкретных клинических случаях ревматоидного артрита и других патологий суставов.
"строма теперь рассматривается как основная мишень воздействия глюкокортикостероидов при воспалительном артрите"
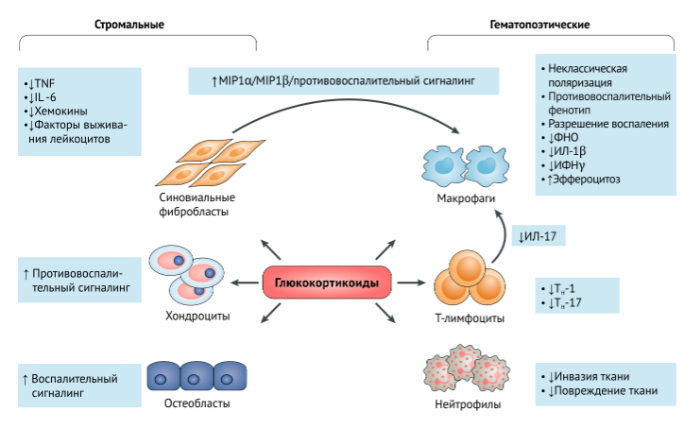
Строма, которая никогда прежде не рассматривалась как цель для ГКС, теперь утверждена в роли мишени для воздействия глюкокортикоидов при воспалительном артрите. Мыши с делецией рецепторов к ГКС в хондроцитах показали развитие воспаления и в модели AIA и в STIA, что может говорить о возможном противовоспалительном эффекте, который оказывает связь ГКС и хондроцитов при артрите. Парадоксальным является то, что взаимодействие глюкокортикоидов с остеобластами, напротив, способствует развитию воспалительного процесса, что видно на модели STIA. В своем исследовании Коэнен с соавторами установили, что стромальные клетки воздействуют на воспаление посредством поляризации макрофагов в сторону суппрессивных фенотипов, что проявляется в усиленном эффероцитозе и выделении противовоспалительны маркеров. То, как хондроциты или остеобласты регулируют воспалительный процесс, остается неясным. Вышеперечисленные данные суммарно позволяют говорить о том, что некоторые типы стромальных клеток (синовиальные фибробласты, хондроциты и остеобласты), а также клетки иммунной системы, обеспечивают работу ГКС при воспалительных заболеваниях суставов (Рис. 1).
"стромальные клетки регулируют воспалительный процесс, увеличивая количество суппрессивных макрофагов"
Дополнительным уровнем регуляции активности ГКС является работа 11-бета-гидроксистероиддегидрогеназы 1-го типа (11β- HSD1). Данный фермент усиливает активность кортикостероидов за счет местной активизации ГКС из их неактивных предшественников. Это ключевой процесс в трансформации неактивных ГКС, таких как кортизон и преднизон, в их активные формы- кортизол и преднизолон. Важно, что 11β- HSD1 никак не воздействует на дексаметазон. Мыши с дефектом выработки 11β- HSD1 намного более подвержены воспалительным процессам в суставах в моделях острого и хронического артрита. Активность данного фермента в макрофагах является важнейшим фактором в ограничении воспаления в этих моделях. Было бы интересно установить, схожими ли окажутся воздействия дексаметазона (из работы Маши Коэнен и ее коллег) с работой кортизона и преднизона, которые регулируются 11β- HSD1 и являются частыми препаратами выбора в терапии РА.
Открытие участия стромальных клеток в метаболизме глюкокортикоидов предоставляет широкий простор для разработки препаратов, сочетающих противовоспалительную эффективность ГКС с отсутствием побочных эффектов. Ранние попытки разработки селективных ГКС или селективных агонистов глюкокортикоидных рецепторов (selective glucocorticoid receptor agonists- SEGRAs) опирались на представление о том, что положительное влияние ГКС является результатом вмешательства мономерного глюкокортикоидного рецептора в работу провоспалительных сигнальных путей (так называемая репрессия или подавление), в то время как побочные эффекты являлись следствием присоединения рецептора к ДНК в виде димера (так называемая активация).
Коллектив ученых во главе с Машей Коэнен исследовали это двойственное действие ГКМ с помощью мышей, у которых ГКС рецепторы не образовывали димеры, и таким образом могли только «репрессировать или подавлять», но не «активировать». В результате было выяснено, что хотя мономер был способен подавлять провоспалительные цитокины, такие как фактор некроза опухоли (ФНО), интерлейкин 1- бета (IL-1β) и гамма интерферон (IFNγ), способность рецептора образовывать димер была ключевой в обеспечении противовоспалительной активности глюкокортикоидов. Эти данные демонстрируют, что упрощенный взгляд на процесс репрессии как на что-то хорошее, а на процесс активации как на что-то плохое, не может создать прочной базы для создания SEGRAs. Так почему бы вместо этого не попробовать разработать SEGRAs на базе теории о селективном таргетировании стромальных клеток? Вероятно, такой выраженный энтузиазм вокруг стромально-ориентированной терапии ГКС обусловлен тем, что все основные побочные эффекты приема глюкокортикоидов (остеопароз, остеонекроз, миопатии и кожная атрофия ) связаны с деятельностью стромальных клеток.
Основным вопросом остается применимость данного подхода к людям с РА и подобными патологиями. Пока неизвестно, насколько животные модели артрита имитируют схожие биологические процессы у человека. Вполне возможно, что во время клинического течения болезни самые важные мишени ГКС будут меняться. Животные модели артрита концентрировались на в большей степени краткосрочном снижение воспаления в суставах под воздействием ГКС терапии, чем на долгосрочных изменениях в течении болезни и состоянии суставов.
К большому сожалению, продуманные экспериментальные методики , которые использовал коллектив ученых Ульмского Университета в этой работе, неприменимы в определении направления воздействия ГКС на стромальные клетки у человека. Для изучения работы ГКС у пациентов с РА необходимы принципиально новые трансляционные подходы. Без них затруднительно будет селективно таргетировать кортикостероиды либо на стромальные, либо на обычные иммунные клетки, и выяснить вклад каждого типа клеток. Сотрудники Института сравнительной молекулярной эндокринологии обнаружили неоткрытые грани в работе ГКС, что предоставляет новые возможности в оптимизации их использования! Несмотря на это, глюкокортикоиды продолжают удивлять нас.
