Интерферонотерапия, применение в клинике и перспективы развития

Интерфероны (IFNs) были впервые описаны в 1957 г. Исааком и Линдеманом как противовирусные соединения, вырабатываемые организмом. С тех самых пор было описано множество свойств этих цитокинов, а изучение их многогранных эффектов на функции клеток и всего организма продолжаются и по сей день. Влияние интерферонов на иммуный ответ позволяет использовать их в качестве терапевтических агентов. Учитывая разнонаправленные эффекты IFNs, сформировались несколько различных направлений в их клиническом применении, а также много методик находится в стадии разработки.
Общее описание интерферонов
В настоящий момент описано 3 класса интерферонов: IFN-I, IFN-II, IFN-III. Первый класс интерферонов (IFN-I) является самым большим: в него входят IFN-α, IFN-β, IFN-ε, IFN-κ и IFN-ω. IFN-α у человека содержит 13 подтипов, все остальные члены класса представлены по одному экземпляру. Все IFN-I передают сигнал через гетеродимерный рецепторный комплекс, состоящий из IFNAR1 и IFNAR2 субъединиц. Эти субъединицы экспрессируются на большинстве клеток организма, что позволяет IFN-I воздействовать на множество клеточных линий. Однако различные типы IFN-I по-разному экспрессируются в тканях и различаются аффинностью связывания с рецепторным комплексом, а следовательно различные подтипы проявляют неодинаковое действие. Связывание IFN-I с рецепторным комплексом активирует фосфорилирование рецептор-зависимых членов семейства JAK-киназ: JAK1 (Janus kinase I) и TYK2 (тирозинкиназа 2). Далее происходит активация сигнальных преобразователей и активаторов транскрипции STAT1 и STAT2. К их гетеродимеру присоединяется IRF9 с образованием комплекса ISGF3 (интерферон-стимулированный эффекторный фактор 3), который транслоцируется в ядро, где вызывает экспрессию интерферон-стимулированных генов (ISG) посредством связывания с элементом ISRE на целевых промоторах. Таким образом, активируется экспрессия множества генов, имеющих данный элемент в промоторе. Этим и объясняется наличие большого количества разных свойств интерферонов.
Единственным представителем класса IFN-II является IFN-γ. Он связывается с субъединицами IFNGR1 и IFNGR2, которые также присутствуют на большинстве типов клеток. Затем происходит связывание еще одного комплекса IFN-γ-IFNGR1-IFNGR2, что активирует передачу. Происходит фосфорилирование JAK1 и JAK2; дальнейшая активация STAT1 и образование гомодимеров STAT1. Димеризованный STAT1 перемещается в ядро, где связывает последовательность GAS в IFN-γ-индуцибельными генами и активирует их транскрипцию.
Последним классом является IFN-III, открытый относительно недавно. В него входят IFN-λ1 (IL-29), IFN-λ2 (IL28A), IFN-λ3 (IL-28B) и IFN-λ4. Сигнал от IFN-λ проводится через рецептор, состоящий из субъединиц IFNλR1 и IL-10R2. Экспрессия этого рецепторного комплекса ограничена эпителиальными клетками, что снижает системное действие IFN-III, однако и уменьшает их побочные эффекты при клиническом использовании. Дальнейший сигнальный путь JAK-STAT не отличается от такового у IFN-I.
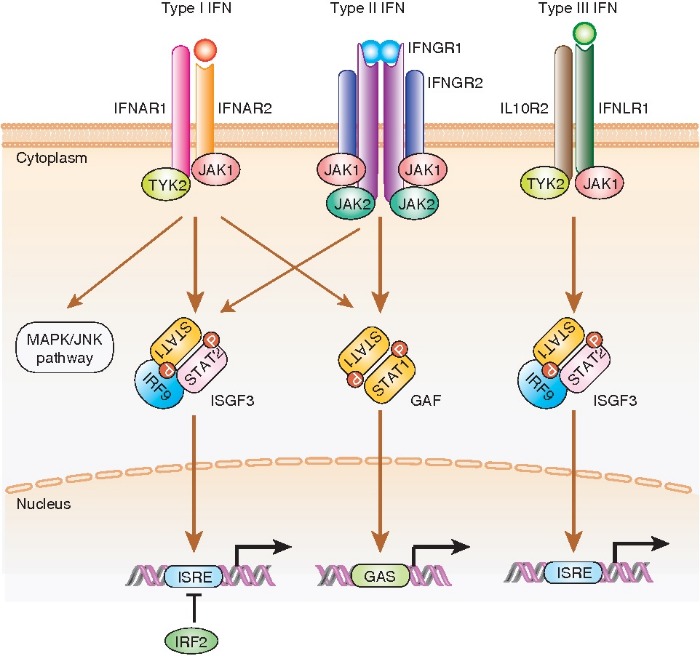
Все интерфероны имеют многогранные эффекты, включая противовирусный, иммуномодулирующий, противоопухолевый. Иммуномодулирующий эффект проявляется как иммуностимулирующим действием, так и иммуноподавляющим. Результирующий эффект зависит от многих факторов и заслуживает отдельного обзора. Противоопухолевый эффект представлен влиянием IFNs как на сами опухолевые клетки (антипролиферативный), так и на микроокружение опухоли (ангиостатический, иммуностимулирующий). Однако это свойство тоже непостоянно, и интерфероны также могут способствовать прогрессии опухоли. Поэтому клиническое использование IFNs, как правило, должно быть комплексным, для поддержания нужных и нивелирования нежелательных свойств этих цитокинов. Различия в генах, стимулированных IFN-I и IFN-II классов, а также разную экспрессию рецепторов IFN-I и IFN-III классов, дают обоснования для дифференцированного клинического применения различных видов интерферонов.
Применение IFN-I
IFN-I первыми начали применять в клинической практике и на данном этапе они больше других классов интегрированы в практическую медицину.
Противовирусное действие
IFN-I обладают выраженным противовирусным эффектом. Совокупность ISG способна влиять на каждый этап жизненного цикла вируса: проникновение в клетку, трансляцию и репликацию вируса, а также выход из клетки. На каждый этап существует множество различных механизмов, которые могут как влиять непосредственно на различные компоненты вируса, так и изменять состояние зараженной клетки, например, метаболизм. В настоящее время IFN-I в качестве противовирусного средства применяются для терапии вирусных гепатитов В (HBV) и С (HCV), а также в качестве этиотропной терапии саркомы Капоши, вызванной человеческим герпес вирусом-8 (HHV-8).
В терапии гепатита С используются комбинации IFN-α с другими противовирусными, например, нуклеозидами (рибаварин), или используют их модифицированную форму, представляющую коньюгат с полиэтиленгликолем — пегинтерферон. Это позволяет уменьшить его почечный клиренс и значительно увеличить период его полувыведения примерно с 5 до практически 90 часов. При комбинированной терапии с рибавирином или применением пегинтерферона более 75 % пациентов с HCV не 1 генотипа (nongenotype 1 HCV) поддерживают устойчивый ответ против HCV, в то время как до 50 % пациентов, инфицированных генотипом 1 HCV, реагируют на это комбинированное лечение.
В настоящее время хронический гепатит В лечат комбинацией пегинтерферона и одного из нескольких нуклеотидных препаратов, которые ингибируют репликацию генома HBV (ламивудин, адефовир, энтекавир или тенофовир). При терапии пегинтерфероном с ламивудином около 60 % пациентов демонстрируют значительный противовирусный ответ, который более эффективен, чем при монотерапии данными препаратами.
Поскольку саркома Капоши вызвана вирусом, было логично попытаться лечить ее с помощью IFN-α. Это лечение может быть местным или системным. Уровень успеха приближается к 60 %, когда терапия IFN-α сочетается с эффективным антиретровирусным лечением. Некоторые вирус-ассоциированные опухоли также поддаются данной терапии. К ним относятся рецидивирующий респираторный папилломатоз и генитальные бородавки.
Противовирусная терапия интерфероном не лишена недостатков. В первую очередь, многие вирусы имеют механизмы, противостоящие IFNs, и такая устойчивость совершенствуется. Поэтому лучшее понимание функций ISG может привести к разработке новых терапевтических средств. К примеру, идет разработка и использование новых химерных IFNs и IFN-подобных молекул, влияющих на определенные ISG. Это позволит минимизировать побочные эффекты, в то же время обеспечивая мощное противовирусное действие. Также возможно использование активации отдельных компонентов сигнального пути IFN.
Противоопухолевое действие
IFN-I проявляют противоопухолевое действие как напрямую, индуцируя повреждения и апоптоз опухолевых клеток, так и стимулируя иммунитет организма на борьбу с опухолью. Показано также, что успех химиотерапевтических средств, таргетных противоопухолевых агентов, лучевой терапии и иммунотерапии зависит от сигнализации IFN типа I. В мышиных моделях рака при нейтрализации IFNAR1 моноклональными антителами отменяется терапевтический эффект моноклональных антител против рецептора 2 эпидермального фактора роста человека (ERBB2). Эффективность химиотерапии на основе антрациклинов против трансплантированных опухолей у мышей также теряется при совместном введении IFNAR1-нейтрализующих моноклональных антител. Показано, что противоопухолевые эффекты облучения теряются у специальной линии мышей с выключенным Ifnar1-геном. Имиквимод — синтетический агонист TLR7 и TLR8, который местно применяется для лечения рака кожи, способствует IFNAR1-зависимому перемещению pDC в опухолевое окружение. Отсутствие Tlr7 или Ifnar1 отменяет терапевтическую активность имиквимода у мышей, несущих меланомы, что коррелирует с уменьшенной экспрессией цитотоксических молекул путем инфильтрации опухоли pDCs. IFN типа I могут участвовать в терапевтической активности блокаторов контрольных точек. Так синергические противоопухолевые эффекты, достигаемые одновременной блокадой CTLA4 и PD-лиганда 1 у мышей с меланомой были потеряны при нарушении стимуляции IFN-I. Пегилированный IFNα-2b используется для лечения резецированной меланомы II и III стадий. Гепатоцеллюлярная карцинома, ассоциированная с HBV, также может лечится с применением IFN-α. Пегилированный IFN-α в сочетании с мультикиназным ингибитором иматинибом может увеличить реакцию на терапию у пациентов с хроническим миелоидным лейкозом (ХМЛ). Более того, лечение пегилированным IFN-α после отмены иматиниба вызывает устойчивую ремиссию у большинства пациентов с ХМЛ. Важно отметить, что у таких пациентов более высокие пропорции циркулирующих CD4+ эффекторных Т-клеток памяти с улучшенной секреторной способностью и центральных CD8+ клеток памяти, чем у здоровых индивидуумов. Перспективные результаты уже получены у пациентов с острым миелоидным лейкозом, хроническим лимфоцитарным лейкозом, первичной кожной лимфомой, рецидивирующей фолликулярной лимфомой, системным мастоцитозом, полицитемией vera, карциномой предстательной железы, устойчивой к кастрации, и тестикулярной тератомой.
Несмотря на важное значение IFN-I для противоопухолевого иммунитета, системная терапия IFN-I не является универсальной. Такая терапия, как было показано, может применяться не для всех типов рака. К тому же, IFN-I обладают и иммуносупрессивными свойствами (например, увеличением производства противовоспалительных IL-10 и IL-27 или индуцированием экспрессии иммунодепрессантного фермента (IDO1) индоламина 2,3-диоксигеназы 1), а его системное введение сопровождается побочными эффектами, такими как повышенная утомляемость, анорексия, гепатотоксичность, гриппоподобный синдром и тяжелая депрессия. По этим причинам ведется активная работа по модификации IFN-I. Так был произведен ряд работ по улучшению доставки IFN-I в микроокружение опухоли. Одним из таких методов является конъюгация интерферона-I с моноклональными антителами. Такие молекулы получили название иммуноцитокины. Иммуноцитокин C22b2b, содержащий тетрамер IFNα-2b, связанный с hL243 (человеческое моноклональное антитело к HLA-DR), показал эффективность против миеломы человека и ксенотрансплантатов лимфомы. IFNβ, конъюгированный с цетуксимабом (клинически одобренным EGFR-нацеливающим моноклональным антителом), ограничивает рост экспрессирующих EGFR опухолей мыши, которые не реагируют на немодифицированный цетуксим. Также конъюгаты IFNα или IFNβ со специфическим моноклональным антителом HER2 более эффективны против HER2-экспрессирующих опухолей, чем немодифицированное моноклональное антитело. Другой подход представляет собой генную модификацию различных клеток таким образом, чтобы усиленно производить IFN-I. NK-клетки, генетически сконструированные для экспрессии человеческого IFNα, улучшили цитотоксичность против клеток гепатоцеллюлярной карциномы in vitro, а также в ксенотрансплантантных моделях опухолей. Мезенхимальные стволовые клетки, модифицированные для экспрессии мышиного IFN, эффективно останавливают рост меланомы, зависимым от Т-клеток и NK-клеток способом. Также практикуется введение индукторов IFN-I в опухоль. 5'-трифосфатные РНК (ppp-РНК) способны стимулировать RIG-I, что приводит к инициированию гибели раковых клеток, а также к получению IFN типа I и других факторов, способствующих врожденному иммунитету. Предпринимаются также попытки генерации новых мультиплексоров CpG-олигодезоксинуклеотидов (ODN) в качестве нанокристаллов, поскольку эти структуры сильно стимулируют продукцию IFNα плазмоцитоидными дендритными клетками и вызывают активные противоопухолевые иммунные ответы. Местное введение полиинозино-полицитиловой кислоты (полиI: С), которая является агонистом TLR3, RIG-I может стимулировать IFNAR1, что приводит к миграции иммунных клеток к неопластическим очагам, индуцируя терапевтически значимые реакции в доклинических моделях меланомы.
Иммуномодулирующее действие
Как было уже упомянуто, IFN-I имеют противовоспалительные и иммуносупрессирующие эффекты. На данном этапе в клинической практике только IFN-β нашел применение в качестве иммуномодулирующего агента. Речь идет о терапии аутоиммунного заболевания — рассеянного склероза (РС). Исследования показали, что внутримышечное лечение IFN-β приводит к снижению годовых рецидивов РС. Добавление натализумаба, рекомбинантного моноклонального антитела к интегринам, увеличивает способность IFN-β подавлять скорость прогрессирования РС. Однако это не единственный случай, к которому может быть применен IFN-I в контексте иммуномодулятора. Мыши с дефицитом рецептора IFN типа I сверхчувствительны к колиту, в моделях этого заболевания, что указывает на то, что IFN типа I играют роль в кишечном гомеостазе. В одном небольшом исследовании большинство пациентов с неспецифическим язвенным колитом (НЯК), которые систематически получали интерферон-β-a1, показали снижение проявления болезни (в качестве клинической меры было использовано ректальное кровотечение). Однако другие исследования не смогли показать терапевтический эффект от IFN-I у пациентов с НЯК, что обосновывает необходимость дальнейшего исследования роли IFN-I в кишечном гомеостазе. Также IFNs подавляют образование остеокластов, клеток, ответственных за эрозию костей. Исследования показали, что образование остеокластов усиливается во время коллаген-индуцированного артрита у мышей с инактивированным IFN-β. Таким образом, IFNs, в частности IFN-β, очевидно, обладают способностью улучшать патологическую резорбцию кости, хотя данное свойство требует всестороннего изучения перед введением в клиническую практику.
Применение IFN-II
IFN-γ является сильным активатором иммунного ответа, одновременно поляризуя его по направлению клеточного иммунного ответа. Он участвует в образовании Th1, активирует фагоцитарное звено иммунитета, усиливает окислительный метаболизм тканевых макрофагов, антителозависимую клеточную цитотоксичность (АЗЦТК) и активность естественных киллеров (NK-клеток).
Клиническое применение
В настоящее время IFN-γ применяется в практической медицине в двух случаях: терапия злокачественного остеопетроза и хронической гранулематозной болезни. Злокачественный остеопетроз — врожденное заболевание с дефектом работы остеокластов, из-за чего страдает физиологическая резорбция кости. В результате увеличения костной массы и уменьшения полости костного мозга возникает тромбоцитопения, анемия и инфекционные осложнения, что обычно приводит к смерти в течение первого десятилетия жизни. Использование IFN-γ эффективно: было отмечено 96 % снижение частоты инфекций. Было обнаружено также, что IFN-γ увеличивает костную резорбцию и улучшает кроветворение. Другая патология — хроническая гранулематозная болезнь — также является наследственной. Наблюдается дефект в продукции фагоцитами бактерицидных супероксидных анионов, что приводит к рецидивирующим опасным для жизни бактериальным и грибковым инфекциям. IFN-γ вызывал 67 % снижение относительного риска серьезных инфекций и двукратное сокращение числа первичных серьезных инфекций по сравнению с группой плацебо. Более того, продолжительность госпитализации была значительно меньше для всех клинических случаев в группе IFN-γ.
IFN-γ-1b также рассматривается как привлекательный вариант терапии пациентов с рефрактерным туберкулезом легких с множественной лекарственной устойчивостью. Аэрозольная форма IFN-γ-1b была признана хорошо переносимой и полезной в качестве адъюванта у пациентов с туберкулезом с множественной лекарственной устойчивостью. Аналогичные результаты из другого исследования, в котором IFN-γ-1b вводили подкожным путем, были обнадеживающими.
Противоопухолевая активность
Практическое применение IFN-γ на данном этапе связано в основном с его противоинфекционной активностью. Однако IFN-γ был рассмотрен и в иных областях, к примеру, в онкологии. Недавно некоторые исследования показали, что активация иммунной системы необходима для эффективной лучевой терапии, а IFNγ играет ключевую роль в эффективности терапии ионизирующим излучением. В мышиной модели рака толстой кишки ионизирующая лучевая терапия не влияет на рост опухоли у мышей с инактивированным IFN-γ, но уменьшает опухолевую нагрузку у интактных мышей. Было выяснено, что IFN-γ уменьшает рост опухолевых клеток путем индукции остановки опухолевого клеточного цикла, апоптоза и некроптоза. Более того, в клеточных линиях колоректального рака IFN-γ выявляет апоптоз путем индукции митохондриальных активных форм кислорода, которые зависят от активации цитозольной фосфолипазы A2. Также IFN-γ способен воздействовать на строму опухоли: он вызывает регресс сосудистой сети опухоли, что приводит к снижению кровотока и последующему коллапсу опухолей. Это напоминает ишемический некроз в отличие от геморрагического некроза, индуцированного TNF-α. Среди иммунных клеток IFN-γ активирует антигенпредставляющие клетки для усиления экспрессии цитокинов (IL-12 и IL-18) и костимулирующих молекул CD86, которые усиливают дифференцировку Th1 и цитотоксическую функцию Т-лимфоцитов (CTL). Сигналы IFN-γ также способствуют устранению опухоли путем ингибирования функций некоторых супрессивных иммунных клеток в опухолях, таких как регуляторные CD4+ Т-клетки (Tregs), миелоидные супрессорные клетки (MDSCs) и связанные с опухолью макрофаги (ТАМ). Список противоопухолевых эффектов обширен, однако есть обстоятельства, мешающие активному клиническому применению IFN-γ в противоопухолевой терапии. Дело в том, что IFN-γ обладает также свойствами, поддерживающими опухолевую прогрессию. К примеру, IFN-γ может вызывать экспрессию iNOS (синтаза оксида азота) в моноцитарных MDSC-полученных макрофагах. iNOS играет ключевую роль в усилении супрессивной активности моноцитарных MDSC и, в свою очередь, уменьшает противоопухолевые Т-клеточные ответы. Индуцированные IFN-γ клетки меланомы экспрессируют ген CTLA-4 человека, который зависит от сигнальных путей IFNGR/STAT1. IFN-γ также индуцирует эпителиально-мезенхимальный переход (EMT) в клетках папиллярного рака щитовидной железы человека (PTC) и увеличивает миграционное и инвазивное поведение клеток PTC. Таким образом, необходимы специальные стратегии лечения, в которых IFN-γ комбинируется с другим средством для снижения подобных эффектов интерферона. Было продемонстрировано, что обработка IFN-γ может побуждать большую часть клеточных линий выражать высокие уровни поверхностного супрессивного PD-L1. Однако обработка IFN-γ клеток опухоли желудка с последующим применением антител к PD-L1 приводит к усилению противоопухолевой CTL-активности. Еще одна перспективная стратегия была указана в исследовательских работах. Обработка клеток аденокарциномы легких с помощью IFN-γ привела к активации путей JAK2-STAT1 и PI3K-AKT. Активация JAK2-STAT1 способствует антипролиферативному эффекту IFN-γ, в то время как активация PI3K-ACT индуцирует экспрессию PD-L1 и снижает его антипролиферативный эффект. Поэтому предполагается, что блокада PI3K может максимизировать опосредованный IFN-γ противоопухолевый эффект. Противоопухолевая активность IFN-γ была продемонстрирована в терапии рака яичников в сочетании с циклофосфамидом и цисплатином, что значительно продлевает выживаемость без прогрессирования. Кроме того, до настоящего времени существует 8 текущих клинических испытаний с участием только IFN-γ или в сочетании с другими противоопухолевыми препаратами. Но в настоящее время, несмотря на то, что IFN-γ имеет ключевое значение для иммунотерапии рака, этот цитокин не был одобрен для лечения пациентов с различными типами рака. Дальнейшее изучение свойств IFN-γ, может привести к появлению новых стратегий терапии рака, поэтому это направление весьма перспективно.
Иммуномодулирующее действие
Наличие иммуносупрессивных свойств IFN-γ, описанных ранее, дает обоснование на рассмотрение использования стратегий, включающих IFN-γ в терапии аутоиммунных состояний. Была представлена уникальная функция IFN-γ защиты олигодендроцитов от демиелинизации. Авторы использовали модель трансгенных животных, позволяющую временно регулировать доставку IFN-γ в центральную нервную систему во время экспериментального аутоиммунного энцефаломиелита (EAE). IFN-γ предотвращал развитие стандартных симптомов EAE, таких как повреждение аксонов, демиелинизация и потеря олигодендроцитов. Роль IFN-γ в демиелинизирующих заболеваний , таких как рассеянный склероз, является спорным, так как были описаны и полезные, и вредные эффекты. Высказывается предположение, что наибольшими защитными свойствами обладает раннее введение IFN-γ, во время начала заболевания.
Применение IFN-III
IFN-λ были открыты сравнительно недавно, поэтому в клинической практике они в настоящее время не используются. Однако, согласно последним исследованием, IFN-λ имеют большой потенциал в практическом применении. Несмотря на то, что сигнальные пути IFN-III соответствуют сигнальным путям IFN-I, существуют различия в их функциональной активности. IFN-λ запускает слабый, но устойчивый ответ ISG; наоборот, IFN-α создает сильный кинетический профиль экспрессии генов, который быстро развивается и подавляется. Различия в локализации рецепторов также дифференцируют ответы IFN-I и III классов.
Противовирусная активность
IFN-λ являются доминирующим классом интерферона, продуцируемым в печени человека и шимпанзе, при инфицировании HCV, при этом IFN-λ ингибирует репликацию HBV. В экспериментах с кишечной ротавирусной инфекцией показано, что IFN-λ необходим для контроля инфекции, но не IFN-I. Сообщается, что IFN-λ способствует устойчивости к гриппу A, гриппу B, SARS, коронавирусу и H1N1 у мышей. IFNs-λ способны ингибировать репликацию нескольких других вирусов, включая ВИЧ, вирус простого герпеса типа 2 (HSV 2), цитомегаловирус (CMV) и вирус энцефаломиокардита (EMCV). Эти данные свидетельствуют о перспективности IFN-λ в противовирусной терапии. Также вследствии ограниченой экспрессии их рецепторов, IFN-III будут иметь меньше системных реакций, чем IFN-I. PEGIFN-λ1 был исследован в клинических испытаниях против HCV; успешное испытание II фазы
продемонстрировало, что IFN-λ1 был столь же эффективным (или несколько более) как PEGIFN-α и имел значительно меньшее количество внепеченочных побочных эффектов, включая тромбоцитопению нейтропении, гриппоподобный синдром, аутоиммунный тиреоидит и легочную артериальную гипертензию. Несмотря на то, что в настоящее время проводится несколько испытаний III фазы, в которых PEGIFN-λ1 комбинируется с другим препаратом, по прогнозам, IFN-λ с меньшей вероятностью будет играть роль для терапии вирусного гепатита С в будущем. Тем не менее, IFN-λ очень перспективен в отношении терапии отдельных инфекций с эпителиальным тропизмом, например, для кишечной инфекции, вызванной ротавирусами или норовирусами, а также респираторных инфекций, вызванных вирусами гриппа или коронавирусами (SARS и MERS). Следует отметить, что эффективность IFN типа III слабее, чем у IFN I типа, и только IFN-λ1 из всех представителей класса в настоящее время разрабатывается как терапевтический препарат.
Противоопухолевое действие
Противоопухолевая активность IFN-III аналогична IFN-I. IFN-λ индуцирует апоптоз у некоторых типов опухолей, в зависимости от экспрессии рецептора (только на эпителиальных клетках). Недавнее исследование показало, что мыши с отсутствием Ifnlr1 более восприимчивы к образованию саркомы и имею большую смертность в трансплантированных опухолевых моделях. Важно отметить, что лечение IFN-λ задерживало летальность и уменьшало развитие саркомы. IFNs-λ индуцируют апоптоз в клетках колоректального рака сильнее, чем IFN-α/β или IFN-γ. В другом недавнем исследовании, где сравнивались противоопухолевые эффекты IFN-α и IFN-λ в модели гепатомы мыши, оба IFN демонстрировали сопоставимую противоопухолевую активность, но комбинация IFN-λ и IFN-α достигала более существенных противоопухолевых эффектов по сравнению с использованием только одного класса IFN. Это дает основания для разработки схем комбинированной терапии интерферонами. На данный момент нельзя сказать, сможет ли IFN-λ стать заменой IFN-I, однако, есть возможность комбинированной терапии интерферонами, а также сочетания с другими противоопухолевыми препаратами. Например, был описан синергетический эффект IFN-λ с бортезомибом или темозолимидом при терапии меланомы. Лечение карциномы пищевода комбинацией IFN-λ и CDDP (цисплатин) или 5-FU (фторурацил) проявляло аддитивный эффект.
Иммуномодулирующее действие
В настоящее время имеющиеся данные свидетельствуют об различных вкладах передачи сигналов IFN-λ в аутоиммунных состояниях. Предполагаются противовоспалительные функции IFN-λ. В экспериментальной мышиной модели аутоиммунного артрита лечение IFN-λ2 приводило к регрессу заболевания и повреждения суставов путем подавления ответов IL-1 и IL-17, а также вербовки нейтрофилов, которые выражают IFN-λR1. Авторы утверждают, что поскольку IFN-λ структурно связан с IL-10 (общая субъединица в рецепторе), он может иметь противовоспалительную активность. Была предложена защитная роль для IFN-λ при аллергической астме. В мышиной модели астмы введение IFN-λ снижает иммунные адаптивные изменения и сводит к минимуму тяжесть заболевания; это связано с производством IL-13 и IL-5, а также снижением Th17-клеточных ответов и инфильтрации легких эозинофилами. В этой модели защитная активность IFN-λ зависела от IFN-γ и IL-12, что приводило к опосредованному IFN-λ Th1-перекосу. Таким образом, существует обоснование терапевтического введения рекомбинантных IFNs-λ при обострениях астмы с целями снижения вирусной нагрузки и модулирования аллергической основы заболевания. Аналогично, введение IFN-λ может быть вариантом лечения ревматоидного артрита.
Обобщая вышесказанное, интерфероны представляют собой чрезвычайно биологически активные молекулы с широким спектром действия и разнообразными эффектами. Разные классы интерферонов демонстрируют свои особенности влияния на организм, однако прослеживаются три основных направления клинического применения интерферонов: противоинфекционное, противоопухолевое и иммуномодулирующее. Соответственно, интерферонотерапия применима к таким областям медицины как онкология, инфекционные и аутоиммунные патологии. Дальнейшее изучение как свойств самих интерферонов, так и комбинирования IFNs с другими препаратами позволит открыть множество новых эффективных терапевтических стратегий в отношении широкого круга заболеваний.
Источники:
1. Kovarik P, Sauer I, Schaljo B. Molecular mechanisms of the anti-inflammatory functions of interferons. Immunobiology. 2007;212(0):895-901. doi:10.1016/j.imbio.2007.09.011.
2. Kotredes KP, Thomas B, Gamero AM. The Protective Role of Type I Interferons in the Gastrointestinal Tract. Frontiers in Immunology. 2017;8:410. doi:10.3389/fimmu.2017.00410.
3. Schneider WM, Chevillotte MD, Rice CM. Interferon-Stimulated Genes: A Complex Web of Host Defenses. Annual review of immunology. 2014;32:513-545. doi:10.1146/annurev-immunol-032713-120231.
4. Friedman RM. Clinical uses of interferons. British Journal of Clinical Pharmacology. 2008;65(2):158-162. doi:10.1111/j.1365-2125.2007.03055.x.
5. Ni L., Lu J. Interferon gamma in cancer immunotherapy //Cancer medicine. – 2018.
6. Green R., Ireton R. C., Gale M. Interferon-stimulated genes: new platforms and computational approaches //Mammalian Genome. – 2018. – С. 1-10.
7. Eslam M., George J. Targeting IFN-λ: therapeutic implications //Expert opinion on therapeutic targets. – 2016. – Т. 20. – №. 12. – С. 1425-1432.
8. Snell L. M., McGaha T. L., Brooks D. G. Type I interferon in chronic virus infection and cancer //Trends in immunology. – 2017. – Т. 38. – №. 8. – С. 542-557.
9. Zitvogel L. et al. Type I interferons in anticancer immunity //Nature Reviews Immunology. – 2015. – Т. 15. – №. 7. – С. 405.
10. Zettl U. K. et al. Interferon β-1a and β-1b for patients with multiple sclerosis: updates to current knowledge //Expert review of clinical immunology. – 2018. – Т. 14. – №. 2. – С. 137-153.
11. Tayal V., Kalra B. S. Cytokines and anti-cytokines as therapeutics—an update //European journal of pharmacology. – 2008. – Т. 579. – №. 1-3. – С. 1-12.
