Настоящее и будущее антиагрегантной терапии: упор на стабилизацию гемостаза

Абстракт | Такие антиагрегантные препараты, как аспирин, антагонисты P2Y12-рецепторов и блокаторы гликопротеиновых рецепторов (GP) IIb/IIIa, хорошо показали себя в снижении заболеваемости артериальным тромбозом и ассоциированной с ним смертности. Потому эти фармакологические агенты являются фундаментом в терапии пациентов с острым коронарным синдромом. Однако для приема всех этих препаратов характерен риск развития кровотечения, который ассоциирован с нежелательными сердечно-сосудистыми исходами и смертностью. Из этого следует, что потенциальные преимущества наиболее мощных традиционных антиагрегантных препаратов, вероятно, будут нивелироваться повышенным риском развития кровотечения. В экспериментах in vivo были выявлены данные о потенциально важных различиях между гемостазом и тромбозом, что расширило перспективы разработки новых антиагрегантных препаратов, прием которых не будет ассоциирован с повышенным риском кровотечений. Более того, на этапе доклинических исследований было выявлено несколько новых антиагрегантных препаратов, которые ингибируют тромбоз, не влияя при этом на гемостаз. К ним относятся ингибиторы фосфатидилинозитол 3-киназы-β (ФИ3Кβ), протеиновой дисульфид-изомеразы (ПДИ), активации GP IIb/IIIa, сигналинга GP IIb/IIIa внутрь клетки, протеаза-активируемых рецепторов и тромбоцитарных GP VI-опосредованных путей адгезии. В данном обзоре авторы говорят о достижении современным антиагрегантами пределов своих возможностей. В частности, обсуждается влияние повышенного риска кровотечения на их общую эффективность. Благодаря последним достижениям в области изучения формирования тромбов, появилась возможность разработки новых препаратов, потенциально более безопасных, чем уже существующие.
Артериальный тромбоз зачастую впервые проявляется инфарктом миокарда (ИМ) или ишемическим инсультом, которые приводят к более чем 14 миллионам смертей ежегодно и являются лидирующей причиной смертности и инвалидизации во всем мире [1]. Из-за распространения нездорового образа жизни бремя артериального тромбоза неуклонно возрастает преимущественно в развивающихся странах. Ожидается, что в ближайшем будущем бремя артериального тромбоза значительно возрастет, будучи следствием «эпидемий» сахарного диабета и ожирения [1, 2]. К тому же, экономическое бремя артериального тромбоза значительно сказывается на расходах на здравоохранение и на утрате производительности труда [3]. С учетом вышесказанного, для решения этой проблемы требуются разноплановые меры, в том числе и разработка новых терапевтических подходов. Учитывая важнейшую роль тромбоцитов в развитии атеротромбоза, антиагрегантные препараты являются ключевыми в профилактике и лечении артериального тромбоза. В данном обзоре предлагается анализ уже имеющихся в настоящее время антиагрегантов с акцентом на кровотечение, которое является главным ограничением для их использования. Освещаются новые таргетные препараты, находящиеся на доклиническом и клиническом этапах испытания, а также обсуждаются общие препятствия, влияющие на перевод этих перспективных подходов в клинику.
Формирование тромба in vivo
Обычно тем событием, что инициирует образование патологических артериальных тромбов, является разрыв атеросклеротической бляшки или острая эрозия эндотелия [4]. В результате обнажаются высокореактогенные субэндотелиальные матриксные белки, к которым относятся фактор фон Виллебранда (ФфВ) и коллаген. Под воздействием напряжения сдвига в артериальном русле связанный с коллагеном ФфВ раскручивается, опосредуя временную адгезию тромбоцитов с помощью комплекса гликопротеинов (GP) Ib–V–IX [5]. Однако для стабильной адгезии тромбоцитов требуется взаимодействие между GP IV, интегрином α2β1 и коллагеном, а также между интегрином α5β1 и фибронектином [6, 7] (Рис. 1). Интересно, что у пациентов с дефицитом GP IV кровотечения обычно протекают в легкой форме. Кроме того, атеросклеротические бляшки крайне богаты коллагеном, что позволило рассматривать GP IV в качестве мишени для антиагрегантной терапии [8]. Активацию тромбоцитов усиливает высвобождение таких растворимых медиаторов, как АДФ, тромбоксан А2 (ТхА2) и тромбин, которые активируют P2Y пуринорецепторы 1 и 12 (P2Y1 и P2Y12), тромбоксан и протеаза активируемые рецепторы, соответственно [9–11]. Внутриклеточные сигналы, генерируемые стимуляцией рецепторов адгезии тромбоцитов растворимыми агонистами, приводят к изменениям конформации главного рецептора адгезии тромбоцитов — GP IIb/IIIa (также известного как интегрин-αIIbβ3) [12]. На покоящемся тромбоците, который может связываться с иммобилизированным, но не с растворимым фибриногеном, GP IIb/IIIa располагается в низкоаффинной конформации. Во время активации тромбоцитов сигналы, генерируемые внутри тромбоцита, приводят к изменениям конформации GP IIb/IIIa из низкоаффинного в высокоаффинное состояние. Активация GP IIb/IIIa обеспечивает связывание его с растворимыми белками плазмы, к которым относятся ФфВ, фибронектин и основной лиганд GP IIb/IIIa — фибриноген, тем самым способствуя устойчивой агрегации тромбоцитов и формированию тромба [12, 13]. Формированию тромба также способствует образование тромбина, который усиливает активацию тромбоцитов и активирует коагуляцию, что приводит к формированию стабилизирующей фибриновой сети [14] (Рис. 1). Антагонист протеиназа-активируемого рецептора 1 (также известного как протеаза-активируемый рецептор 1, PAR1) ворапаксар изначально задумывался как блокатор тромбина — одного из сильнейших агонистов тромбоцитов. Помимо PAR1 тромбоциты также экспрессируют PAR4, который при стимуляции тромбином активируется гораздо медленнее, чем PAR1 [15, 16]. Таким образом, сформировалась концепция, что экспрессия PAR4 потенциально важна в формировании окклюзионного тромба, в то время как PAR1 участвует в важных для гемостаза быстрых реакциях тромбообразования [15, 16].
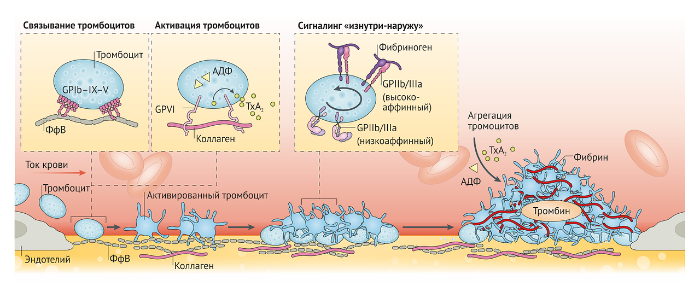
Данные экспериментов показали, что образование артериального тромба более динамично и гетерогенно, чем предполагалось ранее [17]. Известно, что формирование тромба происходит в две отдельные стадии, а значит, в каждом тромбе есть два отдельных [18]. Тромбоцитарная реакция на участке повреждения артерии представляет собой формирование ядра из активированных тромбоцитов, расположенных вблизи очага поражения, и весьма зависима от таких растворимых агонистов, как тромбин [18–20]. Растущий «хвост» тромба, напротив, состоит из слабо активированных тромбоцитов, а процесс их вовлечения в тромбоз крайне слабо отвечает на традиционные антикоагулянты [17, 18]. Эти находки позволили сформировать концепцию отличия гемостатического ответа (ядра тромба) и тромботического ответа, который регулирует развитие растущей части тромба (Рис. 2).
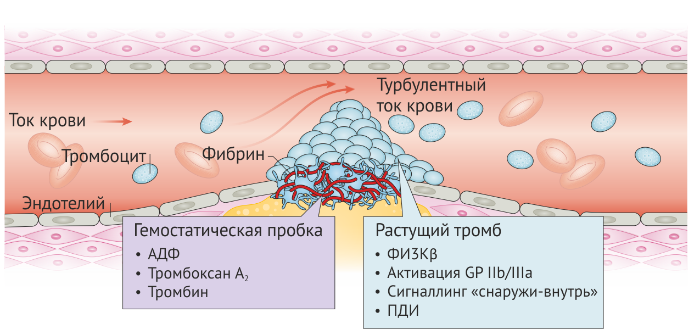
При разработке новых терапевтических агентов, которые подавляют тромбоз, не влияя на гемостаз, исследователи все чаще обращают внимание на факторы, которые регулируют рост тромба. Представляется, что важную роль в регуляции этого процесса играют нарушения ламинарного потока крови, связанные с атеросклеротическими поражениями, стенозами артерий [17]. Агрегация неактивных тромбоцитов в ответ на патологические изменения кровотока высокозависима от сигналинга фосфатидилинозитол 3-киназы-β (ФИ3Кβ) [21]. Это очень важно, так как тромбы обычно образуются в артериях с развившимся атеросклерозом и серьезным сужением просвета [22].
Экспериментальные данные подчеркивают принципиально новые представления о молекулярных механизмах связанного с GP IIb/IIIa сигналинга [23]. Как обсуждалось ранее, активация тромбоцитов приводит к передаче сигналов изнутри клетки наружу и активации GP IIb/IIIa. В то же время, связанный с лигандом GP IIb/IIIa также способствует передаче сигналов внутрь клетки, что опосредует реорганизацию цитоскелета и распластыванию тромбоцитов [24]. Важно отметить, что на ранних фазах опосредованная GP IIb/IIIa передача сигналов внутрь клетки, по-видимому, участвует в формировании тромбов, но может быть несущественна в обеспечении нормального гемостаза [25].
Кроме того, растущее число доказательств демонстрирует важную роль протеин дисульфид-изомеразы (ПДИ) в формировании тромба [26]. ПДИ является членом семейства тиоловых изомераз, которые играют важную роль в процессах фолдинга и модификации белков дисульфидными связями [26]. В доклинических исследованиях было продемонстрировано, что ПДИ, полученная из тромбоцитов, играет важную роль в обеспечении аккумуляции тромбоцитов, но не в инициации фазы адгезии тромбоцитов, а значит, она не участвует в нормальном гемостазе [27]. Интересно, что ПДИ, которая высвобождается из поврежденных клеток эндотелия, по-видимому, опосредует образование фибрина и формирование тромба in vivo [28]. Кроме того, ингибирование ПДИ in vivo заметно ослабляет образование фибрина, что не коррелирует с антиагрегантным эффектом такого воздействия [27]. Однако еще предстоит выяснить механизмы, определяющие протромботические эффекты ПДИ.
Все эти открытия указывают на выраженные различия между тромботической и гемостатической реакциями, что можно использовать в терапевтических целях. Селективное подавление процесса аккумуляции тромбоцитов, не затрагивающее критически необходимую для гемостаза инициальную стадию адгезии, может привести к разработке эффективных антиагрегантных стратегий, которые не будут увеличивать риск развития кровотечений.
Настоящее антиагрегантной терапии
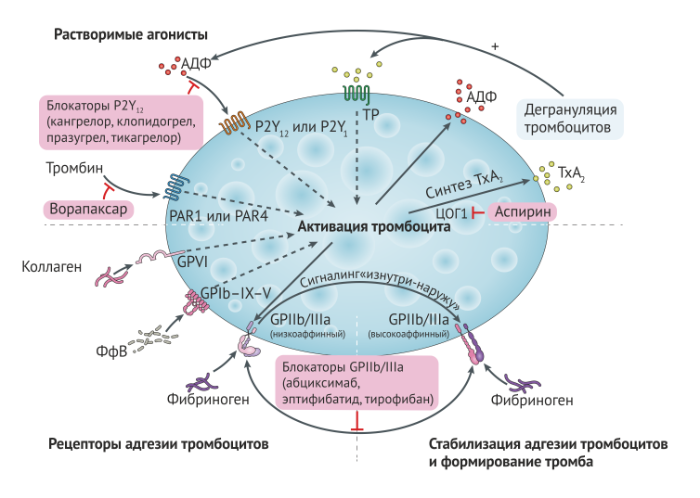
Антиагрегантные препараты являются фундаментом в лечении пациентов с острым коронарным синдромом (ОКС), стабильной стенокардией и перенесших различные процедуры реваскуляризации, в особенности чрескожное коронарное вмешательство (ЧКВ) [29, 30]. В настоящее время в клинике используются четыре класса препаратов (Рис. 3), как самостоятельно, так и в комбинации: ингибиторы циклооксигеназы 1 (ЦОГ1; аспирин), ингибиторы рецепторов АДФ P2Y12 (кангрелор, клопидогрел, прасугрел и тикагрелор), антагонисты PAR1 (ворапаксар) и ингибиторы GP IIb/IIIa (абциксимаб, эптифибатид и тирофибан) [31]. Цилостазол, антиагрегантный препарат, ингибирующий фосфодиэстеразу, в настоящее время одобрен управлением по контролю качества пищевых продуктов и лекарственных препаратов (FDA) только для лечения заболеваний периферических сосудов.
Аспирин
Аспирин блокирует продукцию ТхА2 путем необратимого связывания с ЦОГ-1, тем самым ингибируя индуцированную ТхА2 активацию и агрегацию тромбоцитов (Рис. 3). Аспирин является первой линией антиагрегантной терапии при ОКС, снижая относительный риск смерти на 23 % спустя 5 недель использования [32–34]. Кроме того, аспирин обеспечивает значительные преимущества в качестве вторичной профилактики, снижая относительный риск ИМ на 25 % [35].
ЦОГ1 — циклооксигеназа 1; ТР — тромбоксановый рецептор.
Антагонисты P2Y12-рецепторов
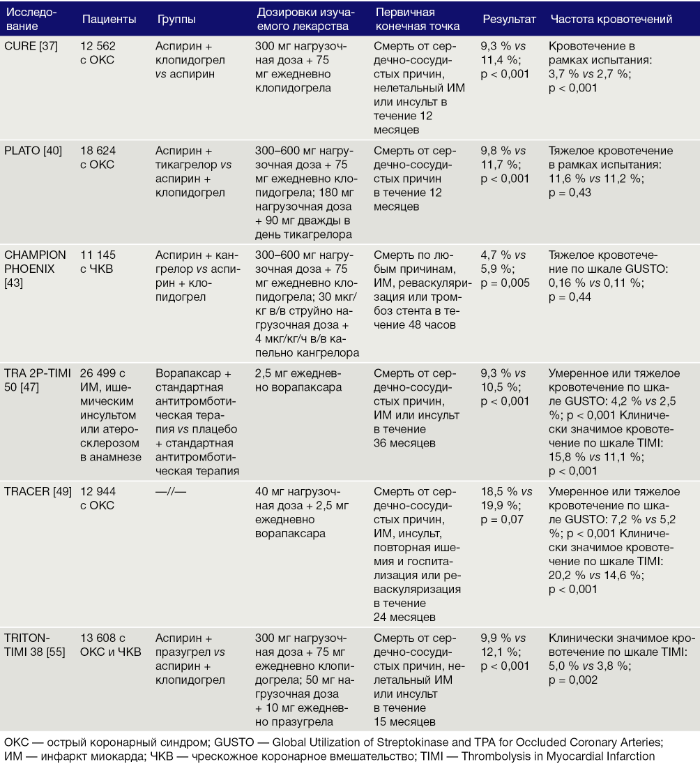
Антагонисты P2Y12-рецепторов играют важную роль в обеспечении устойчивой активации главного рецептора адгезии тромбоцитов — GP IIb/IIIa, — в ответ на стимуляцию АДФ [36]. Антагонисты P2Y12-рецепторов ингибируют АДФ-индуцированное усиление активации тромбоцитов (Рис. 3), что выражается в их сильном антитромботическом ээфекте [36]. Однако рецидивирующие ишемические атаки возникают примерно у 10 % пациентов через 12 месяцев, несмотря на двойную антиагрегантную терапию (ДААТ) аспирином и клопидогрелем [37]. Кроме того, у 30–40 % пациентов, получающих клопидогрел, реактивность тромбоцитов продолжает расти. Эти проблемы легли в основу разработки новых антагонистов P2Y12-рецепторов [36, 38].
К ингибиторам P2Y12 относятся два класса препаратов: тиенопиридины (клопидогрел, прасугрел и тиклопидин) и производные нуклеозид-нуклеотидов (кангрелор и тикагрелор). Все тиенопиридины представляют собой применяемые перорально пролекарства, которые превращаются плазменными эстеразами или цитохромом Р450 (CYP450) в печени в активные метаболиты, которые необратимо ингибируют рецептор P2Y12. Прасугрел in vivo обладает большей биодоступностью, сильнее потенцирует антиагрегантный эффект и его эффект меньше зависит от индивидуальных особенностей организма, чем у клопидогрела [39]. Нуклеозид-нуклеотидные антагонисты, напротив, представляют собой ингибиторы рецептора P2Y12 прямого действия и не нуждаются в CYP450-опосредованной активации. Тикагрелор — оральный антагонист P2Y12 прямого действия, который был одобрен в масштабных рандомизированных контролируемых исследованиях [40]. В отличие от клопидогрела или прасугрела, тикагрелору не требуется метаболическая активация, а его антиагрегантный эффект более предсказуем, чем у клопидогрела [36, 41]. Кангрелор — это другой антагонист P2Y12-рецепторов обратимого прямого действия, который был одобрен FDA и Европейским медицинским агентством (ЕМА) [42] и быстро начинает действовать, обладая коротким периодом полувыведения (3–6 минут), что обеспечивает быстрое восстановление функции тромбоцитов [36]. Таким образом, кангрелор представляет собой вариант терапевтического вмешательства в клинических сценариях, когда необходимо ингибирование P2Y12 в краткие сроки с быстрым достижением компенсации, как у пациентов с ОКС при неэффективности антагонистов-P2Y12 или при необходимости в срочном проведении ЧКВ, или же у тех, кто нуждается в ДААТ перед операцией [43].
Антагонисты PAR-1
Тромбин, по своей природе являющийся ферментом-протеазой, играет важную роль в коагуляции [44], а его активность в условиях атеросклеротического поражения повышена [45]. Комбинация блокаторов тромбина с ДААТ рассматривалась в качестве потенциальной антитромботической стратегии [44, 46]. Реакция человеческих тромбоцитов на тромбин первично опосредована через два PAR-рецептора, которые связаны с G-белком: PAR-1 и PAR-4 [44]. На основании исследования TRA 2P–TIMI 50 [47], антагонист PAR-1 ворапаксар был одобрен FDA для лечения ишемических атак у пациентов с ИМ или заболеванием периферических сосудов в анамнезе [48]. Однако добавление ворапаксара к стандартной антиагрегантной терапии не повышало не повышало ее эффективность относительно ОКС [49]. Важно отметить, что как в исследовании TRA 2P–TIMI 50 [47], так и в исследовании TRACER [49], частота кровотечений, в том числе и внутричерепных кровоизлияний, значительно увеличивалась при добавлении к схеме ворапаксара (Табл. 1). Более того, частота внутричерепных кровоизлияниях значительно возрастала у пациентов с ишемическим инсультом в анамнезе. Из вышесказанного следует, что опасения о безопасности ограничивают использование ворапаксара в клинической практике, а сам препарат противопоказан пациентам с инсультами, транзиторными ишемическими атаками или внутричерепными кровоизлияниями в анамнезе.
Таблица 1 | Главные клинические испытания III фазы с участием блокаторов P2Y12 и блокаторов PAR1.
Ингибиторы GP IIb/IIIa
Ингибиторы GP IIb/IIIa представляют собой имитирующие лиганды молекулы, которые препятствуют связыванию фибриногена с активированными тромбоцитами, тем самым напрямую ингибируя их агрегацию (Рис. 3). В настоящее время используются три препарата: абциксимаб — гуманизированный антигенсвязывающий фрагмент моноклонального антитела мыши; эптифибатид — циклический гептапептид с мотивом лизин-глицин-аспарагиновая кислота (KGD), который имитирует связывающую фибриноген последовательность GP IIb/IIIa (RGD-мотив); а также тирофибан — небольшая молекула непептидной природы, также имитирующая участок связывания фибриногена [50]. Впервые появившиеся на рынке в середине 1990-х годов, эти препараты широко используются у пациентов с ОКС и у лиц, перенесших ЧКВ. Однако ранние клинические испытания ингибиторов GP IIb/IIIa были проведены до появления в клинической практике антагонистов P2Y12. Таким образом, клинические преимущества ингибиторов GP IIb/IIIa, по всей видимости, ограничены определенными подгруппами высокого риска, такими как перенесшие ЧКВ пациенты с ИМ, которые ранее не получали антагонисты P2Y12 [51–53]. Хотя ингибиторы GP IIb/IIIa являются мощными антитромботическими препаратами, осложнения в виде кровотечений развиваются примерно у 50 % пациентов [54].
Существующие рекомендации по лечению
Множеством исследований продемонстрировано, что ДААТ в виде сочетания аспирина и антагонистов P2Y12 обеспечивает заметное снижение частоты ишемических событий по сравнению с приемом только аспирина [37, 48]. Эти результаты привели к широкому использованию клопидогрела. В дальнейшем было показано, что новые мощные антагонисты P2Y12, такие как прасугрел и тикагрелор обеспечивают больший клинический эффект, чем клопидогрел [40, 55] (Табл. 1). Поэтому в существующих руководствах АСС, АНА [56] и ESC [57] рекомендовано комбинировать аспирин с новейшими антагонистами P2Y12, а не с клопидогрелом у пациентов с ОКС и лиц, перенесших ЧКВ. Клинические преимущества, а, следовательно, и использование антагонистов GP IIb/IIIa являются противоречивыми, а сами они обычно рекомендуются в качестве «терапии отчаяния» или пациентам с тромботическими осложнениями, возникшими во время ЧКВ [57]. Как обсуждалось выше, ворапаксар, в дополнение к стандартной антиагрегантной терапии, эффективен в качестве вторичной профилактики сердечно-сосудистых событий. Однако использование ворапаксара ограничено высокой частотой развития кровотечений, ассоциированной с этим препаратом и его важными противопоказаниями.
Заболеваемость и смертность, опосредованные кровотечениями
Преимущества ДААТ в снижении риска рецидивов ишемических исходов должны быть сбалансированы с риском развития кровотечений. У многих пациентов с высоким риском сердечно-сосудистых исходов также повышен риск развития кровотечения, потому такие люди зачастую не получают наиболее эффективную антитромботическую терапию. Важно отметить, что наиболее высокие показатели кровоточивости были отмечены у пациентов, получающих ДААТ в наиболее интенсивных режимах, содержащих новейшие антагонисты P2Y12 (прасугрел и тикагрелор) или при добавлении ворапаксара [37, 40, 55, 58] (Табл. 1). В исследовании TRITON-TIMI 38 [55] добавление прасугрела к аспирину увеличивало частоту тяжелых кровотечений по шкале TIMI, не связанных с АКШ: 2,4 % в сравнении с 0,1 %; Р = 0,002) в сравнении с сочетанием аспирина и клопидогрела. В исследовании PLATO [40] использование тикагрелора привело к увеличению частоты тяжелых кровотечений по шкале TIMI, не связанных с АКШ: 2,8 % в сравнении с 2,2 %; Р = 0,03), а также к увеличению частоты тяжелых внутричерепных кровоизлияний в сравнении с клопидогрелом (0,1 % в сравнении с 0,001 %; Р = 0,02). Эти результаты стали причиной рекомендации ESC о том, что прасугрел и тикагрелор не должны использоваться у пациентов с геморрагическими инсультами в анамнезе [57]. Интересно, что исследование TRACER [49] показало, что добавление ворапаксара к стандартной антиагрегантной терапии увеличивало частоту кровотечений(в т. ч. кровотечений среднетяжелой и тяжелой степени в соответствии с критериями GUSTO (Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries): 7,2 % в сравнении с 5,2 %; Р < 0,001) и частоту внутричерепных кровоизлияний (1,1 % в сравнении с 0,2 %; Р < 0,001). Эти результаты важны, учитывая то, что большинство пациентов в группе лечения ворапаксаром также получали ДААТ на момент госпитализации (99 % аспирин; 91,9 % клопидогрел) [49]. В исследовании CURRENT-OASIS 7 [59] у пациентов с ОКС высокие дозы клопидогрела (600 мг в 1-й день, по 150 мг на 2–7 сутки, затем по 75 мг ежедневно) сравнивались со стандартной дозой (300 мг в 1-й день, затем по 75 мг ежедневно). Увеличенная доза не снижала частоту ожидаемых сердечно-сосудистых исходов за 30 дней, но была ассоциирована с увеличением частоты тяжелых кровотечений (1,7 % в сравнении с 1,3 %; Р = 0,03) в сравнении со стандартной дозой клопидогрела [59].
Учитывая, что все существующие антиагрегантные агенты ингибируют процессы, необходимые для нормального гемостаза, возможно, достигнут предел клинических преимуществ, так что увеличение интенсивности терапии ассоциируется с увеличением риска кровотечения. Из-за увеличения риска внутричерепного кровоизлияния (и ишемического инсульта для прасугрела), ворапаксар и прасугрел противопоказаны пациентам с инсультами в анамнезе. Кровотечение развивается у 1–10 % пациентов, подвергшихся ЧКВ или иному лечению ОКС, а также растет убеждение в том, что кровотечение является главным фактором, определяющим краткосрочные (такие как ИМ, инсульт и тромбоз стента [58, 60–62]) и долгосрочные неблагоприятные исходы, в т. ч. смерть [58, 60, 63, 64]. Эти клинические наблюдения подчеркиваются в исследовании TRANSFUSION-2 [65], где продемонстрировано, что реактивность тромбоцитов увеличивается (частично в ответ на АДФ) после переливания эритроцитарной массы. Таким образом, у пациентов с ОКС при кровотечении и трансфузии увеличивается риск тромбозов.
Также изучена эффективность различных режимов антиагрегантной терапии, включающих антикоагулянт ривароксабан. В исследовании GEMINI ACS-1 [66] сочетание ривароксабана в низких дозах с антагонистами P2Y12-рецепторов у пациентов с ОКС не приводило к увеличению кровоточивости в сравнении со стандартной ДААТ. Однако для оценки ишемических исходов исследования не проводилось [66]. В исследовании COMPASS [67] продемонстрировано, что добавление низких доз ривароксабана к аспирину у пациентов со стабильными сердечно-сосудистыми заболеваниями снижает частоту сердечно-сосудистых исходов (сочетание смерти от сердечно-сосудистых заболеваний, ИМ и инсульта), при сравнении с монотерапией аспирином (4,1 % в сравнении с 5,4 %; Р < 0,001). Однако это преимущество ривароксабана связано с увеличением риска кровотечения (3,1 % в сравнении с 1,9 %; Р < 0,001) [67]. В текущих клинических исследованиях, таких как GLOBAL LEADERS [68] и TWILIGHT [69], оценивается, обеспечивает ли монотерапия тикагрелором антитромботический эффект без увеличения частоты кровотечений в сравнении с ДААТ, в том числе и среди пациентов с высоким риском со стентами с лекарственным покрытием. Тем не менее, остается потребность в новых антитромбоцитарных стратегиях, которые позволят обеспечить более безопасное, эффективное и обширное ингибирование тромбоцитов, чем существующие на сегодняшний день.
Новые терапевтические цели
Ингибиторы оси GP Ib–ФфВ
В местах повреждения сосудов комплекс GP Ib–IX–V связывается с ФфВ при участии субъединицы GP Ib. Взаимодействиям между GP Ib и ФфВ способствуют условия высокого напряжения сдвига потока крови в артериях, которое обычно наблюдается при стенозе артерий [17, 70–72]. Доклинические модели артериального тромбоза свидетельствуют о том, что мыши с нокаутом или модификацией по GP Ib защищены от формирования артериальных тромбов [73–75]. Более того, были разработаны различные ингибиторы оси GP Ib–ФфВ: антитела к GP Ib [76] или ФфВ [77, 78], антагонист GP Ib, полученный из змеиного яда [79], анти-ФфВ аптамер [80] и рекомбинантные фрагменты GP Ib [81] или ФфВ [82], — демонстрирующие антитромботические эффекты (Рис. 4). Однако разработка двух анти-ФфВ агентов: аптамера (ARC1779) и однодоменного антитела (каплацизумаб), — имеющих антитромботические эффекты, была остановлена из-за увеличения частоты кровотечений [83, 84]. II фаза испытаний показала, что ARC1779 устраняет тромбоэмболию сосудов головного мозга после каротидной эндартерэктомии. Однако две трети пациентов, получавших ARC1779, испытывали геморрагические осложнения, которые не возникали у тех, кто получал плацебо [83]. Каплацизумаб тестировался в комбинации с ДААТ у пациентов с ОИМ, перенесших ЧКВ. Однако разработка этого препарата была остановлена в 2011 году, поскольку профиль риска кровотечения был аналогичен таковому при сочетании ДААТ и абциксимаба [84]. Эти данные подчеркивают важность поддержания нормального гемостаза для успешной разработки новых антиагрегантных препаратов.
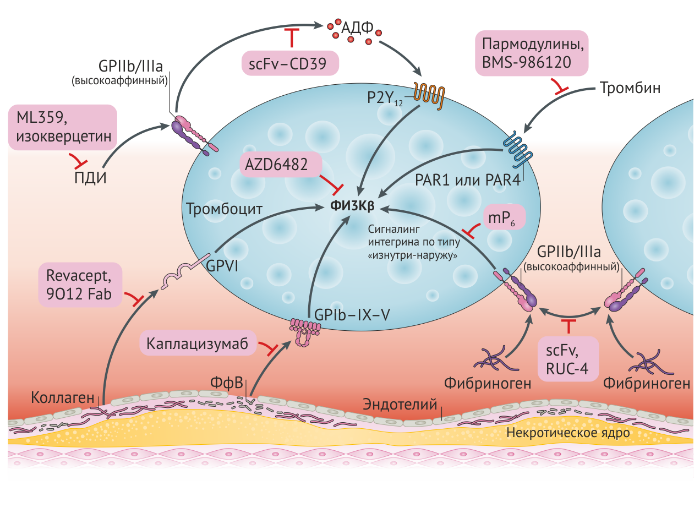
Ингибиторы ФИ3Кβ
ФИ3К — это семейство липидных киназ, β-изоформа которых играет важную роль в сигнальных путях, активируемых тромбоцитарными рецепторами GP Ib, P2Y12 и GP IIb/IIIa. ФИ3Кβ также играет важную роль в обеспечении стабильной адгезии тромбоцитов в условиях высокого напряжения сдвига [85]. Таким образом, в доклинических моделях ФИ3Кβ-дефицитные мыши демонстрировали защищенность от артериального тромбоза, которая не сопровождалась увеличением времени кровотечения [86]. Эти результаты послужили основой для разработки AZD6482, специфической изоформы ингибитора ФИ3Кβ, который прошел I фазу испытаний на 40 здоровых мужчинах [87]. AZD6482 обладает мягким антиагрегантным эффектом и ингибирует агрегацию тромбоцитов в ответ на малые дозы тромбоцитарных агонистов, а также адгезию и агрегацию в условиях высокого напряжения сдвига, умеренно удлиняя время наружного кровотечения [87] (Рис. 4). Важно отметить, что в ходе испытания у семи человек развились носовые кровотечения, однако этот эффект наблюдался преимущественно в период выведения препарата из организма и у шести мужчин после нормализации функции тромбоцитов in vitro [87]. В другом исследовании было показано, что ингибирование ФИ3Кβ с помощью AZD6482 в комбинации с аспирином продемонстрировало больший антиагрегантный эффект in vitro, чем при сочетании аспирина и клопидогрела у здоровых добровольцев [88]. Еще предстоит выяснить, как соотносится антитромбоцитарный эффект AZD6482 и аспирина с комбинацией наиболее сильных антагонистов P2Y12 в сочетании с аспирином. В эксперименте продемонстрировано, что в дополнение к ингибированию рекрутинга тромбоцитов в растущем тромбе, ингибирование ФИ3Кβ с помощью AZD6482 делает тромбы более склонными к эмболизации [89]. Еще не изучено, приводит ли этот эффект к эмболизации и окклюзии сосудов микроциркуляторного русла по направлению тока крови. Учитывая то, что возможно только внутривенное введение AZD6482, а период его полувыведения короток, ведутся работы над улучшением его фармакокинетического профиля и селективности в отношении ФИ3Кβ. Этот агент готов пройти дальнейшие клинические испытания [90].
Ингибиторы GP IIb/IIIa
GP IIb/IIIa — наиболее распространенные рецепторы адгезии тромбоцитов, количество которых достигает 80000 копий на поверхности каждого тромбоцита. Адгезивная функция GP IIb/IIIa необходима для стабильной адгезии и агрегации тромбоцитов, а ее важность особенно заметна при врожденном дефиците GP IIb/IIIa — тромбастении Гланцмана, — который приводит к увеличению склонности к кровотечению. Основным недостатком используемых в настоящее время ингибиторов GP IIb/IIIa, которые блокируют все циркулирующие тромбоциты, является увеличение риска кровотечений, ассоциированного с этой мощной антиагрегантной стратегией. Кроме того, лиганд-подобные ингибиторы GP IIb/IIIa, такие как используемые в текущей клинической практике, после связывания с GP IIb/IIIa могут индуцировать конформационные изменения, становясь причиной тяжелой тромбоцитопении или парадоксальной активации тромбоцитов [91–93]. Эти проблемы, присущие лиганд-подобным ингибиторам GP IIb/IIIa, могут быть уравновешены мощным антиагрегантным эффектом, который достигается краткосрочной блокадой GP IIb/IIIa при помощи внутривенных агентов. Однако у некоторых пациентов эти проблемы были выявлены при долгосрочном применении ингибиторов GP IIb/IIIa, что способствовало отказу от этого класса препаратов [94].
Был разработан низкомолекулярный антагонист αIIbβ3, известный как RUC-4, который может стать альтернативой имеющимся в настоящее время препаратам. RUC-4 связывается с участком ионного связывания металла на β-субъединице интегрина, тем самым ингибируя связывание лиганда [95] (Рис. 4). В отличие от других ингибиторов GP IIb/IIIa, RUC-4 не индуцирует конформационных изменений в GP IIb/IIIa или парадоксальной активации тромбоцитов [95]. Кроме того, на этапе доклинических исследований RUC-4 показал высокую антитромботическую эффективность [95]. Интересной стороной RUC-4 является возможность его внутримышечного введения, которая повышает удобство его применения на догоспитальном этапе. Однако RUC-4 ингибирует неактивный GP IIb/IIIa и, соответственно, все циркулирующие тромбоциты. Профиль риска кровоточивости для этого препарата еще не установлен и, вероятно, именно он и определит судьбу RUC-4.
Разработаны различные стратегии, прицельно влияющие на функцию GP IIb/IIIa и демонстрирующие сильную антитромботическую активность, при этом, пока что, не было отмечено их значительного влияния на гемостаз. Одним из двух перспективных подходов является конформационно-специфическое нацеливание на GP IIb/IIIa, при котором ингибируется только активированный GP IIb/IIIa [96] (Рис. 4). Все доступные в настоящее время ингибиторы GP IIb/IIIa функционируют независимо от конформации молекулы-мишени. Напротив, избирательное нацеливание на активную конформацию GP IIb/IIIa ингибирует рост и стабилизацию тромба, но не образование начальной гемостатической тромбоцитарной пробки на поврежденном сосуде, поскольку этот процесс зависит от GP IIb/IIIa, находящегося в неактивном состоянии [94, 96]. Действительно, эта стратегия была апробирована на доклинических моделях тромбоза, где одноцепочечный вариабельный фрагмент (scFv), нацеленный против активной конформации GP IIb/IIIa, заметно ингибировал тромбоз, но это не было связано с удлинением времени кровотечения [96]. С целью выхода за рамки исключительного ингибирования GP IIb/IIIa и обеспечения коммерческой жизнеспособности разработки препарата, конформационно-специфический к GP IIb/IIIa scFv может также быть использован в избирательной таргетной антитромботической терапии для борьбы с образованием тромба. scFv в сочетании с гидролизирующим АДФ ферментом CD39 [97], сильнодействующим антикоагулянтным пептидом, который является ингибитором фактора Ха [98] и фибринолитиком — урокиназой [99] на этапе доклинических испытаний продемонстрировал сильный антитромботический эффект без влияния на гемостаз. Однако многообещающие данные, полученные на доклинических моделях, должны быть подтверждены клиническими исследованиями, доказывающими наличие тех же преимуществ для пациентов.
Дальнейшие разработки, нацеленные на GP IIb/IIIa, включают специфическое ингибированние ранних фаз опосредованного интегрином сигналинга внутрь клетки. Связывание фибриногена с GP IIb/IIIa обычно вызывает каскад внутриклеточных реакций, которые опосредуют рост тромба, секрецию гранул и ретракцию сгустка [25]. В экспериментах было установлено, что избирательное ингибирование взаимодействия внутриклеточного домена субъединицы β3 и Gα13 с мотивом миристоилированного пептида ЕхЕ (mP6) может избирательно ингибировать опосредованный GP IIb/IIIa сигналинг внутрь клетки (Рис. 4). Интересно, что этот подход, по-видимому, не препятствует инициации адгезии тромбоцитов или первичной агрегации, но защищает от формирования окклюзионного тромба in vivo, не влияя на гемостаз [25]. Таким образом, прицельное воздействия на внутриклеточный сигналинг интегрина является перспективным методом диссоциации протромботической и гемостатической функций GP IIb/IIIa [100].
Ингибиторы PAR
Как обсуждалось выше, антагонисты PAR, такие как ворапаксар, являются эффективными антитромботическими препаратами, но их применение связано с существенным повышением смертности от кровотечений [47]. В настоящее время представляют интерес разработки нового класса антагонистов PAR 1, называемых пармодулинами [101]. В отличие от ортостерических ингибиторов, таких как ворапаксар, которые ингибируют все нисходящие сигналы от рецепторов PAR1, пармодулины селективно блокируют PAR1-зависимую активацию тромбоцитов и клеток эндотелия, что не сопровождается ингибированием цитопротективных сигнальных путей в клетках эндотелия [102]. Эти соединения демонстрируют на моделях мелких животных антитромботические эффекты, которые не сопровождаются изменениями гемостаза [102]. В настоящее время предприняты усилия по разработке пармодулиновых соединений, которые будут иметь высокую биодоступность при пероральном применении и благоприятный фармакологический профиль [101].
Тромбоциты также экспрессируют PAR4, а в работе, опубликованной в прошлом году продемонстрировано, что специфическое воздействие на PAR4 может иметь внушительный антитромботический потенциал с минимальным ущербом для гемостаза [103]. Считается, что активация PAR4 играет роль, отличную от PAR1, в пути активации, опосредованном тромбином. Действительно, считается, что PAR4 вовлечен в более поздние стадии активации тромбоцитов, чем PAR1 и опосредует стабилизацию агрегации тромбоцитов в присутствии больших концентраций тромбина [15, 16]. Был разработан новый антагонист PAR4 (BMS-986120), который в испытаниях на приматах продемонстрировал антитромботический потенциал, схожий с таковым у клопидогрела, но с минимальными эффектами на гемостаз [103]. В настоящее время BMS-986120 проходит оценку в I фазе клинических испытаний [104].
Новейшие регуляторы тромбообразования
Ингибиторы ПДИ
Роль ПДИ в регуляции тромбообразования вызвала значительный интерес к ПДИ, как к новейшей мишени антиагрегантной терапии [105]. Доклинические данные демонстрируют, что ингибирование ПДИ подавляет как аккумуляцию тромбоцитов, так и образование фибрина на участках повреждений сосудов [26, 28] (Рис. 4). Интересно, что флавоноиды группы кверцетина являются ингибиторами ПДИ и повсеместно присутствуют во фруктах и овощах [105]. Поскольку такие ингибиторы ПДИ, как изокверцетин, имеют признанный высокий профиль безопасности, эффективность этих соединений в снижении частоты венозных тромбозов в настоящее время проходит тестирование во II–III фазах клинических испытаний у пациентов с онкологическими заболеваниями [104, 106]. Также были идентифицированы и готовы подвергнуться дальнейшим испытаниям их антитромботической активности такие ингибиторы ПДИ, как ML359, которые являются более селективными и более эффективными [105]. Еще предстоит определить потенциальную роль ингибиторов ПДИ как терапевтической стратегии в контексте сердечно-сосудистых заболеваний, а также ассоциированный с ними риск развития кровотечений.
Взаимодействие GP VI и коллагена
GP VI является главным рецептором, который опосредует активацию тромбоцитов коллагеном. Связывание GP VI с обнаженным коллагеном приводит к образованию перекрестных связей с GP VI, результатом чего является активация тромбоцитов, что приводит к высвобождению таких растворимых агонистов, как ТхА2 и АДФ и активации GP IIb/IIIa [107]. Хотя GP VI имеет решающее значение в реакции тромбоцитов на коллаген, пациенты с дефицитом GP VI обычно склонны только к кровотечениям легкой степени [8]. Причина, по которой GP VI имеет минорное значение для гемостаза, остается неясной, но возможно это связано с тем, что другие тромбоцитарные агонисты, в особенности тромбин, обеспечивают достаточную компенсаторную активацию [108]. Напротив, дефицит или блокада GP VI антителами в доклинических моделях артериального тромбоза обеспечивают защиту от него [109].
Эти наблюдения, совместно с наблюдениями о тромбоцитарной специфичности GP VI, позволили предположить, что воздействие на этот белок может привести к эффективному антитромботическому воздействию в сочетании с минимальным риском кровотечения (Рис. 4). В настоящее время две стратегии прицельного воздействия на GP IV продвинулись в развитии. Первая основана на антигенсвязывающем фрагменте моноклонального антитела мыши, известном как 9О12.2, который связывает и блокирует участок связывания коллагена GP VI и имеет высокий аффинитет [110]. Этот подход имеет доказанную антитромботическую эффективность на доклинических моделях тромбоза и минимально воздействует на гемостаз [110]. Гуманизированный scFv 9O12.2 готов вступить в раннюю фазу клинических испытаний [111].
Второй анти-GP VI препарат, Revacept, состоит из рекомбинантной димерной формы эктодомена GP VI, объединенной с кристаллизующимся фрагментом иммуноглобулина человека G1 (igG1) [112]. В первой фазе клинических испытаний Revacept не вызывал нежелательных реакций и эффективно ингибировал индуцированную коллагеном агрегацию тромбоцитов человека ex vivo [112]. Эти многообещающие результаты побудили начать II фазу клинических испытаний, чтобы оценить преимущества комбинации Revacept с аспирином у пациентов с клинически значимым стенозом сонной артерии, транзиторной ишемической атакой, транзиторной слепотой или инсультом [113]. Считается, что механизм действия этого препарата состоит в конкуренции с GP VI за связывание с коллагеном на поверхности эндотелия. Интересно, что этот терапевтический подход особенно эффективен в ингибировании агрегации тромбоцитов на атеросклеротической бляшке ex vivo в условиях потока, что позволяет предположить высокую антитромботическую эффективность Revacept на участках разрыва атеросклеротической бляшки [114].
Перспективы и будущие направления
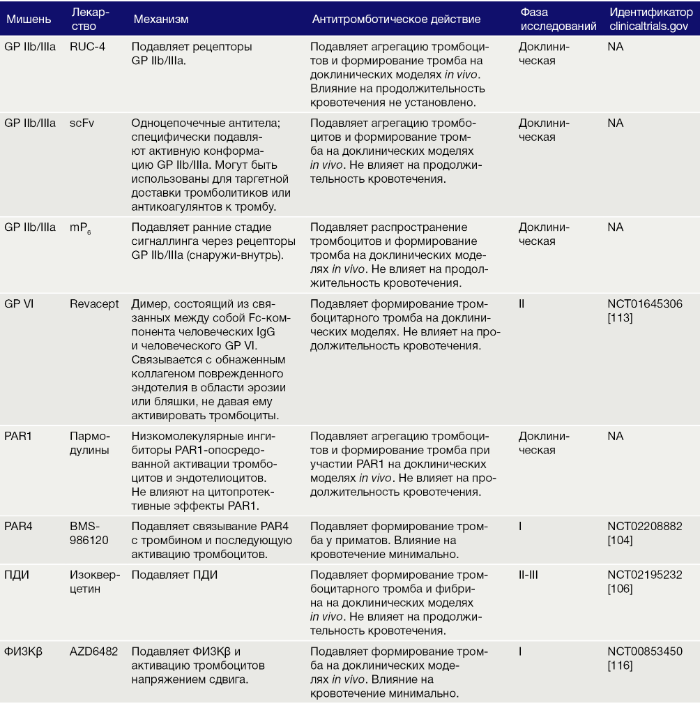
Терапевтические стратегии, обсуждаемые в этом обзоре, достаточно эффективны в предотвращении формирования тромба без воздействия на гемостаз, что подтверждено на доклинических животных моделях и в ранних фазах клинических испытаний (Табл. 2). Однако важно, что животные модели тромбоза не полностью отражают формирование тромба на атеросклеротических бляшках человека, что затрудняет трансляцию результатов с животных на людей. Кроме того, в доклинических испытаниях оценка гемостаза преимущественно зависит от измерения времени продолжительности кровотечения после введения препарата [96, 115]. Таким образом, остаются вопросы о значимости времени продолжительности кровотечения, обычно используемого в доклинических моделях, в предотвращении индуцированных препаратами гемостатических нарушений. Эти ограничения, пожалуй, лучше всего демонстрируют разработки каплацизумаба и ворапаксара. Казалось, ни один препарат не приводил к изменениям гемостаза на доклинических моделях животных. Однако во II–III фазах клинических испытаний, при совместном использовании с ДААТ, оба препарата были ассоциированы с повышенной частотой кровотечений. Потому эти вопросы необходимо принимать во внимание при разработке и внедрении будущих антиагрегантных препаратов, учитывая серьезные клинические данные в пользу ДААТ при ОКС. Соответственно, вполне вероятно, что новые методы лечения будут тестироваться у пациентов, которые уже принимают один или несколько антиагрегантных препаратов. Для пациентов с ОКС и одновременной фибрилляцией предсердий, которым необходимы ДААТ и антикоагулянтная терапия, новые антиагрегантные препараты, которые не влияют на гемостаз, принесут большую пользу. Скорее всего, в краткосрочной перспективе комбинация аспирина и антагонистов P2Y12 останется стандартом лечения. В долгосрочной перспективе новые открытия позволят определить новые терапевтические цели, что приведет к расширению арсенала антиагрегантных препаратов, не имеющих связанных с кровотечениями ограничений применения.
Таблица 2 | Новые антиагреганты, проходящие доклинические, и ранние фазы клинических испытаний.
Заключение
Не вызывает сомнений польза современных антиагрегантных препаратов, но высокий риск кровотечений ограничивает их использование. Исследования, проведенные за прошедшее десятилетие, позволили глубже понять молекулярные механизмы регуляции тромбоза и гемостаза и, что наиболее важно, различия в этих механизмах. Появились различные новые антитромботические стратегии, которые показали себя многообещающе в испытаниях на животных. Теперь на горизонте находятся антиагрегантные стратегии, селективно ингибирующие патологический тромбоз. Предстоит выяснить, как эти потенциально новые терапевтические методики впишутся в существующую парадигму антиагрегантной терапии и будут ли они использоваться в клинике как более безопасные сочетания. Однако с постоянными успехами в понимании процессов формирования тромба и гемостаза, мы находимся на пороге захватывающей новой эры развития антиагрегантных препаратов, которые, как надеются авторы, обеспечат безопасное и эффективное лечение большему числу пациентов.
