РНК-терапия
“Однажды, давным-давно, РНК научились двигаться. Так и началась жизнь”
— Гарри Ноллер
Вашему вниманию представляется совместный проект Cell Picture Show и Института РНК-терапии Медицинской школы Массачусетского университета в Вустере (Массачусетс, США). Объединяясь с клиницистами, специалисты в области фундаментальных и прикладных исследований нуклеиновых кислот ведут поиск новых лекарственных препаратов. Совместной целью учёных и врачей является создание новой парадигмы для организации молекулярных исследований, которая позволила бы как можно скорее применять новые открытия в биологии для решения проблем здоровья человека. В данном выпуске Cell Picture Show показаны прекрасные микрофотографии, отображающие все области исследований, которые проводит Институт РНК-терапии: от осложнений течения беременности до нейродегенеративных заболеваний.
1. Магистрали киРНК
Socheata Ly, Anastasia Khvorova Lab,
RNA Therapeutics Institute, UMass Medical School
Сегодня мы способны применять РНК-терапию; мы знаем роль РНК и можем использовать их для специфичного сайленсинга (“замалчивания”) генов, отвечающих за болезни. Сама концепция относительно проста: выбирается РНК-мишень, создаётся комплементарная ей последовательность, изменяется экспрессия генов и ген, отвечающий за болезни, замалчивается. Однако в реальности всё сложнее. Одним из препятствий, которые необходимо преодолеть, является доставка этих РНК-блокирующих молекул к их предполагаемой цели (или целям). Лаборатория Хворовой работает над стратегиями успешной доставки этих молекул в различные органы и клетки, где происходит экспрессия генов, отвечающих за заболевания.
Изображение: Микроскопия структурированного освещения (SIM-микроскопия) клетки линии COS-7, экспрессирующей маркер ранних эндосом GFP-EEA1 (зелёный), после обработки флуоресцентно меченными, химически модифицированными короткими интерферирующими РНК, киРНК (красный). Большая часть поглощённых киРНК проходит через эндосомы, в которых преобладает EEA1. Ядро окрашено DAPI (синий) — флуоресцентным красителем для ДНК.
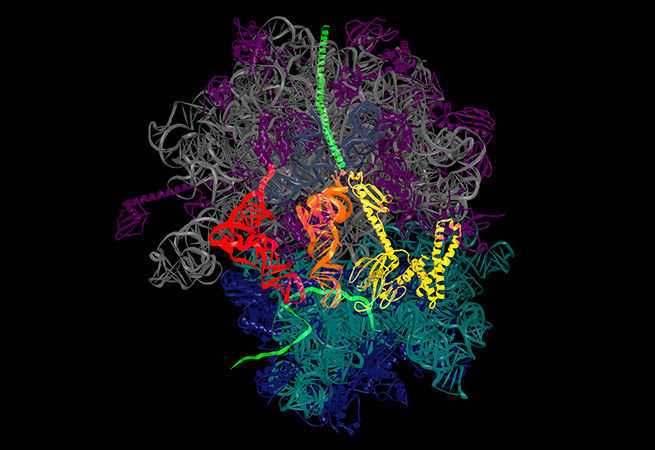
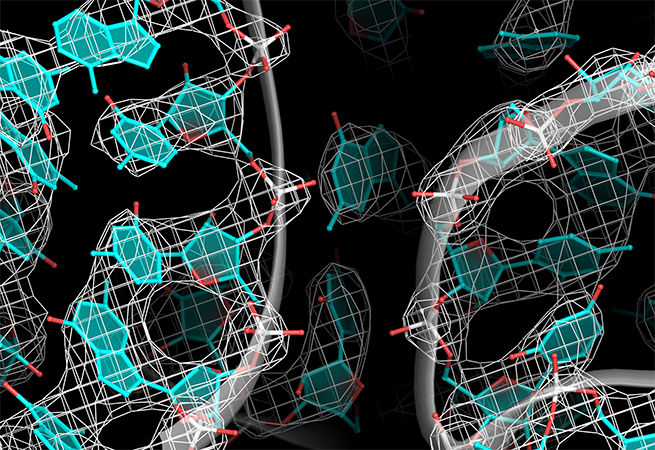
2. RIBO-коп
Andrei Korostelev
RNA Therapeutics Institute, UMass Medical School
Рибосомы — важный компонент для поддержания жизни. Их функция заключается в расшифровке генетического кода РНК для создания белков. В Лаборатории Коростелева доказали существование механизма, с помощью которого рибосомы сохраняют точность генетического кода. Поскольку рибосомы корректируют свои инструкции, периодически могут возникать “грамматические ошибки”: при воздействии неверной “буквой” рибосомы не могут правильно закрепиться, и “буква” стирается.
Изображение: Рентгеновская кристаллография, показывающая структуру рибосомы.
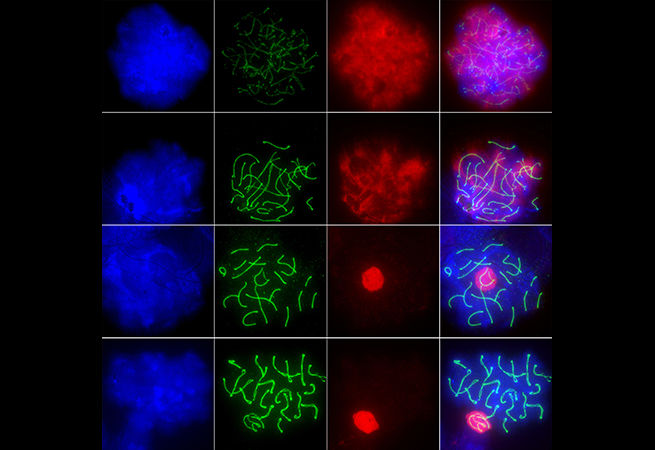
3. Распределяй хромосомы и размножайся
Cansu Colpan, Phillip Zamore Lab
RNA Therapeutics Institute, UMass Medical School
Сперматозоиды проходят долгий путь, чтобы достичь своего Святого Грааля — яйцеклетки. Вот снимок только одной из их задач во время мейоза. Стадия профазы сперматогенеза состоит из четырёх фаз: лептотены, зиготены, пахитены и диплотены. Здесь, на препарате яичек мыши, показаны все четыре стадии расхождения хромосом в мейозе. Начиная с лептотены (верхний ряд) и в зиготене (второй ряд) гомологичные хромосомы образуют пары, также называемые зиготеновым букетом, поскольку теломеры группируются на одном конце ядра. На стадии пахитены (третий ряд) спаренные хромосомы сокращаются и конденсируются. Наконец, на стадии диплотены (четвёртый ряд) спаренные хромосомы начинают разделяться на две пары хроматид и формируются хиазмы (точка, в которой две гомологичные хроматиды обмениваются генетическим материалом в ходе кроссинговера).
Изображение: Сперматоциты окрашивались DAPI (синий), антителом anti-SYCP3 (зеленый) и антителом γ-H2AX (красный), а затем визуализировались методом флуоресцентной микроскопии. На стадии лептотены каждая хромосома видна как две тонкие нити.
4. Молчание — розовое
Julia Alterman, Bruno Godinho, Matthew Hassler, and Socheata Ly; Anastasia Khvorova Lab
RNA Therapeutics Institute, UMass Medical School
С 1998 года, когда Крейг Мелло и Эндрю Фаер (Craig Mello and Andrew Fire) открыли РНК-интерференцию (RNAi), исследователей очень интересует возможность применения этого механизма для лечения заболеваний. РНК-интерференция представляет собой молекулярный путь, в процессе которого можно подавить экспрессию (т.е. осуществить сайленсинг) гена путём использования различных типов РНК, включая микроРНК (miRNA) и короткие интерферирующие РНК (киРНК, siRNA). При активации этого пути RNAi способна подавить экспрессию практически любого гена-мишени, в том числе генов заболеваний, которые обычно считаются фармакологически “неизлечимыми”. В настоящее время Лаборатория Хворовой работает над режимом доставки этих потенциальных терапевтических средств для лечения множества заболеваний.
Изображение: Микроскопия структурированного освещения (SIM-микроскопия) флуоресцентно меченных, химически модифицированных киРНК (красный) в нейронах коры головного мозга мыши после однократного введения метки в полосатое тело. Ядро окрашено DAPI (синий).
5. Симфония № 70S в Рибо-мажоре
Andrei Korostelev
RNA Therapeutics Institute, UMass Medical School
Рибосомы можно сравнить с дирижёром, управляющим исполнением симфонии, ведь процесс трансляции белков не менее сложен. Рибосома управляет множеством молекулярных инструментов (например, мРНК и тРНК), что приводит к успешному исполнению верной мелодии (синтезу белков с правильной аминокислотной последовательностью). Это впечатлило бы даже Йозефа Гайдна!
Изображение: Крио-ПЭМ (просвечивающая электронная микроскопия) нуклеотидов субъединицы 70S рибосомы.
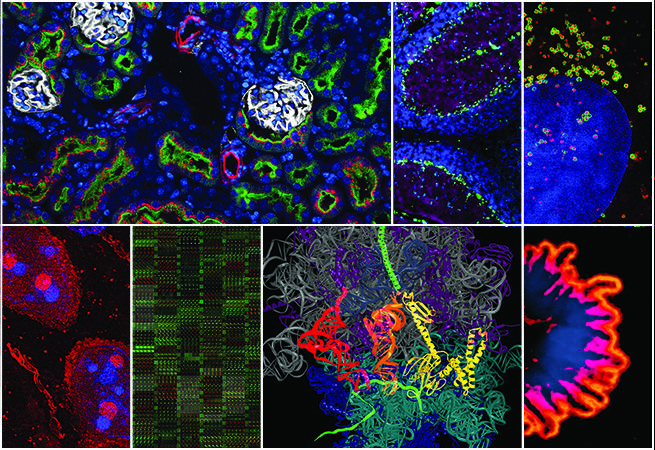
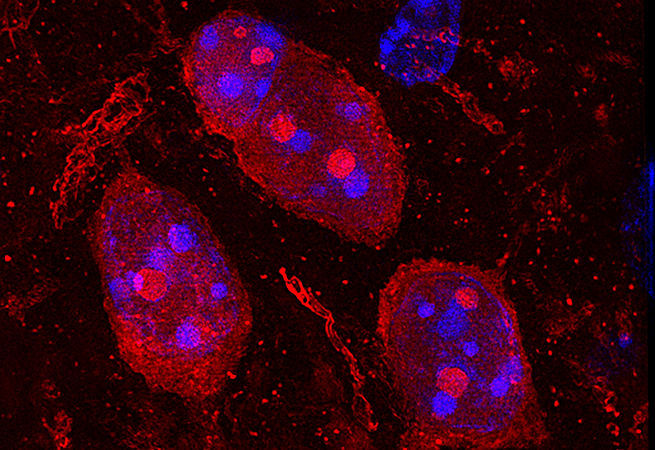
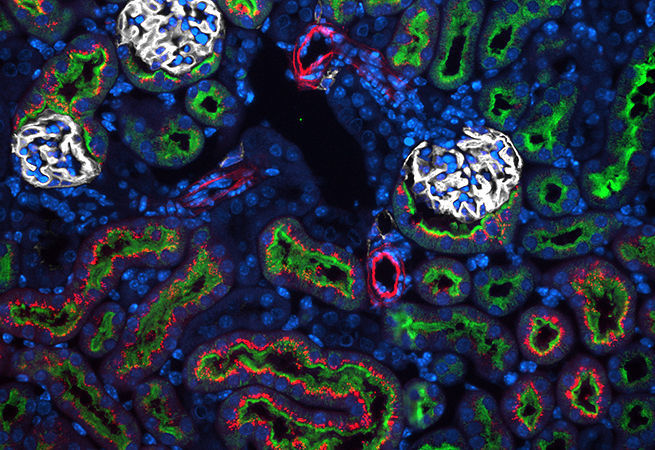
6. Найти и спасти
Andrew Coles and Jovenal San Agustin, Anastasia Khvorova and Gregory Pazour Laboratories
UMass Medical School
Геном человека весьма богат информацией. Он состоит из 3 миллиардов пар оснований, распределённых по 23 парам хромосом. Каждая хромосома включает сотни и тысячи генов, кодирующих инструкции для создания белков. Чтобы разработать терапию конкретных заболеваний, сначала необходимо в этом огромном архиве данных найти повреждённые гены. За последнее десятилетие было создано множество инструментов для поиска, замены или включения/выключения таких генов, приводящих к заболеваниям. Можете считать это личным гугл-поиском для ваших клеток.
Изображение: Мышам подкожно вводили фосфохолин-содержащий конъюгат докозагексаеновой кислоты (DHA) и гетерогенных коротких интерферирующих РНК (hsiRNA) (PC-DHA-hsiRNA, красный). Почки извлекали, фиксировали и окрашивали LTA (зеленый, проксимальные канальцы), DAPI (синий) и T1α (белый, почечные тельца).
7. Не убивайте матричную РНК
David Grunwald
RNA Therapeutics Institute, UMass Medical School
Матричную РНК (мРНК) можно рассматривать как генетические инструкции клетки, которые экспортируются ядром и предназначены для трансляции в белки “фабриками” под названием рибосомы. Благодаря фундаментальным исследованиям, выявившим механизмы трансляции белка с помощью запрограммированных инструкций мРНК, сегодня мы можем применять эти знания для разработки вакцин и других препаратов для лечения таких заболеваний, как рак и вирусная инфекция Зика.
Изображение: Визуализация одиночных мРНК (зелёный) и ядерной оболочки (красный) в живых клетках дрожжей. Проанализирован ядерный экспорт мРНК. Разрешение по времени составляет 17 миллисекунд. 810 панелей соответствуют данным из 405 000 изображений. Группы из 10 изображений показывают усреднённые временные точки одной видеозаписи (правый верхний угол полноэкранной проекции, девять последовательных временных точек).
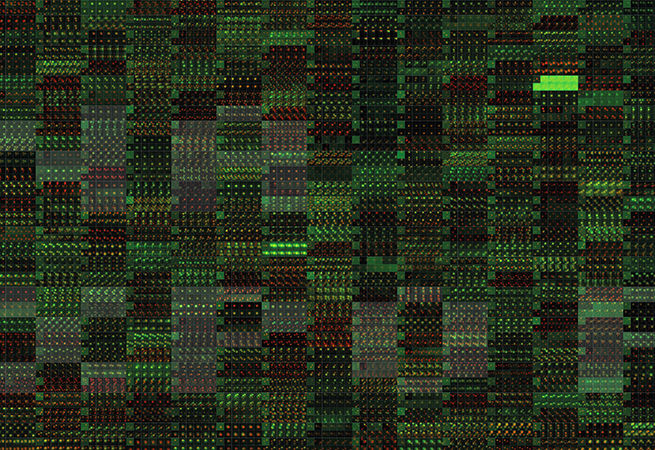
8. Молчание генов
Julia Alterman, Anastasia Khvorova Lab
RNA Therapeutics Institute, UMass Medical School
Одной из проблем при разработке препаратов для РНК-терапии выступает возможность доставки препарата к определённым тканям организма. В настоящее время Лаборатория Хворовой работает над модификацией молекул РНК, которая обеспечит их более эффективную доставку к тканям, таким как мозг. На фотографиях показан мозг мыши, в котором после введения в спинномозговую жидкость киРНК, для которых непосредственной мишенью является ген Htt, отвечающий за болезнь Гентингтона, происходит сайленсинг этого гена.
Изображение: Флуоресцентная микроскопия срезов мозга мыши (синий — ядро, розовый — киРНК, направленные на Htt).
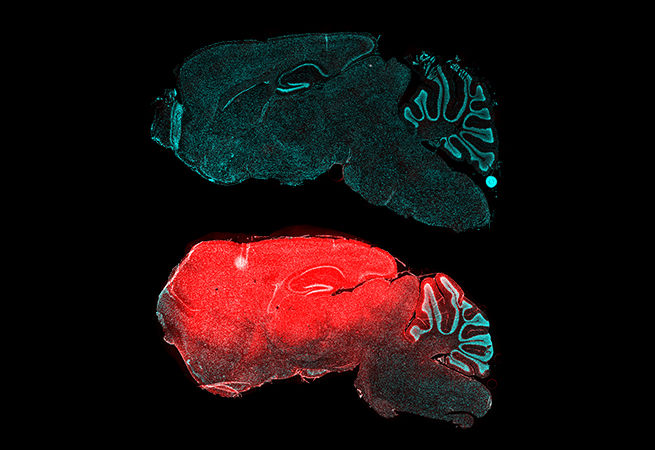
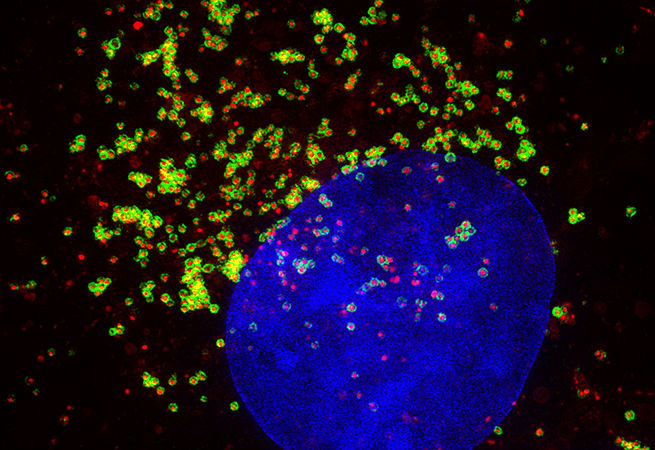
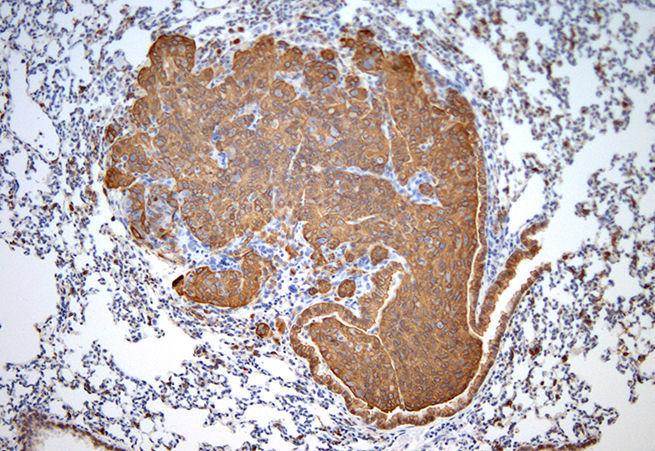
9. Один раз отрежь
Wen Xue
RNA Therapeutics Institute, UMass Medical School
Сегодня CRISPR пользуется особой популярностью. Исследователи используют технологию CRISPR/Cas9 для редактирования генома, позволяющего модифицировать гены в живых клетках и организмах. Возможно, в будущем реальностью станет исправление мутаций в конкретных точках генома человека, позволяющее устранить генетическую причину заболевания.
Изображение: Срез ткани после иммуногистохимического окрашивания. Опухоль лёгкого дала положительный результат на маркер жёлчных протоков и холангиокарциномы, цитокератин 19 (Ck19, коричневый). Изображения получены при помощи световой микроскопии (объектив 10×).
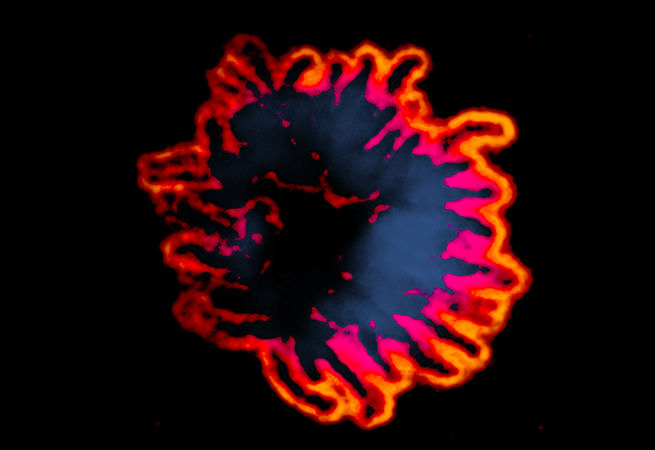
10. Прикрой свои хромосомы!
Anastassiia Vertii, Paul Kaufman Lab
UMass Medical School
Во время митоза хромосомы покрывает загадочный слой белков, известный как перихромосомный слой. Многие из этих белков являются важными компонентами различных клеточных процессов, включая синтез матричной РНК, сборку рибосом, восстановление двухцепочечных разрывов ДНК, поддержание теломер и регуляцию апоптоза.
Изображение: Маркер пролиферации Ki67 — один из лучших примеров ядрышковых белков, которые в митозе мигрируют с образованием перихромосомного слоя. Одиночная плоскость изображения, полученного при конфокальной микроскопии клетки линии RPE-1 в митозе; иммунное окрашивание антителом против Ki67.
11. Танец Гентингтона
Marie-Cecile Didiot, Anastasia Khvorova Lab
RNA Therapeutics Institute, UMass Medical School
Симптомы хореи Гентингтона (ХГ) были описаны ещё в XVI веке. Термин “хорея”, по-гречески — “танец”, использовался для описания нарушений координации движений, характерных для ХГ. Из-за неустановленной природы этой болезни больных иногда обвиняли в одержимости дьяволом, а в XVII веке некоторые из них даже преследовались как ведьмы.
Применение RNAi для исследований в области неврологии было ограничено из-за отсутствия простых и эффективных методов доставки олигонуклеотидов в мозг. Гидрофобная модификация киРНК (hsiRNA) — достижение Лаборатории Хворовой — позволяет нейронам поглощать киРНК при захвате холестерина без необходимости в переносчике. Учёные выявили функциональные hsiRNA, нацеленные на мРНК гентингтина, для специфичного сайленсинга этого гена (мутация гена гентингтина отвечает за болезнь Гентингтона).
Изображение: Поглощение hsiRNA к гентингтину в течение 1 часа в клетках линии HeLa (синий — ядро, красный — hsiRNA, зеленый — эндоплазматический ретикулум).
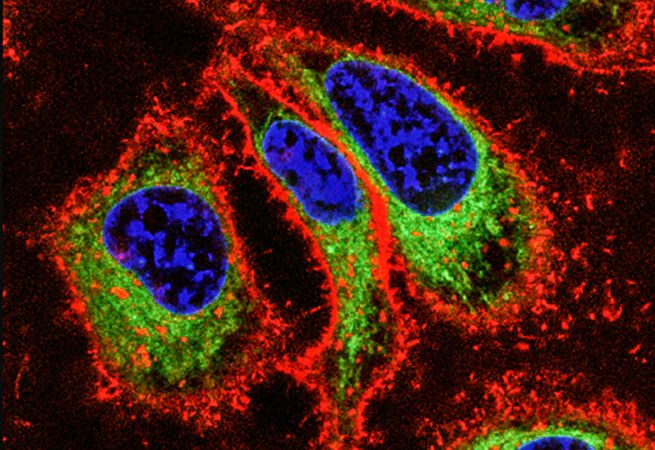
12. Смысловые или антисмысловые?
Mike Moazami, Jonathan Watts Lab
RNA Therapeutics Institute, UMass Medical School
Антисмысловые олигонуклеотиды представляют собой одноцепочечные ДНК или РНК, комплементарные определённой последовательности. Антисмысловые олигонуклеотиды блокируют трансляцию белков, связываясь со специфическими последовательностями матричных РНК, в то время как для антисмысловой ДНК мишенью может выступать специфическая комплементарная РНК. Как вы можете себе представить, нацеливание на специфичные последовательности, кодирующие гены болезни, открывает убедительную терапевтическую стратегию для многих заболеваний.
Изображение: Инвертированная микроскопия мозжечка мыши после инъекции в желудочки головного мозга (ядро — синий, белок гентингтин — фиолетовый, меченный Cy5 антисмысловой олигонуклеотид — зелёный).
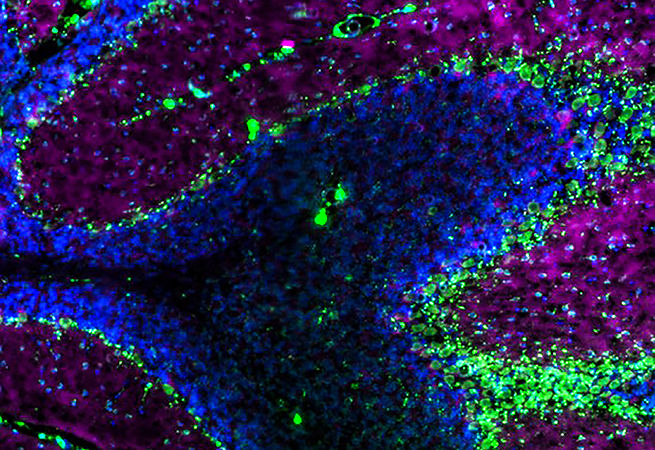
13. Становясь вирусными
Jill Perreira, Abraham Brass Lab
UMass Medical School
Белок RNASEK, расположенный на поверхности клетки, необходим для эндоцитоза, или поглощения клеткой молекул. RNASEK также требуется для внедрения в клетку через эндосомы и последующей репликации определённых вирусов, таких как вирус гриппа A, вирус лихорадки денге и риновирус человека (ответственный за 50% случаев простуды). В недавней статье Cell Reports, используя короткие интерферирующие РНК (киРНК) для сайленсинга белка RNASEK, Лаборатория Брасса показала, что утрата этого белка предотвращает репликацию нескольких патогенных вирусов.
Изображение с высоким разрешением получено с использованием системы “OMX: DeltaVision Localization Microscopy” и метода белковой комплементации световой микроскопии (CALM): Микроскопия нижней поверхности клетки линии HeLa. Реконструкция псевдоокрашена, чтобы привлечь внимание к отдельным структурам.
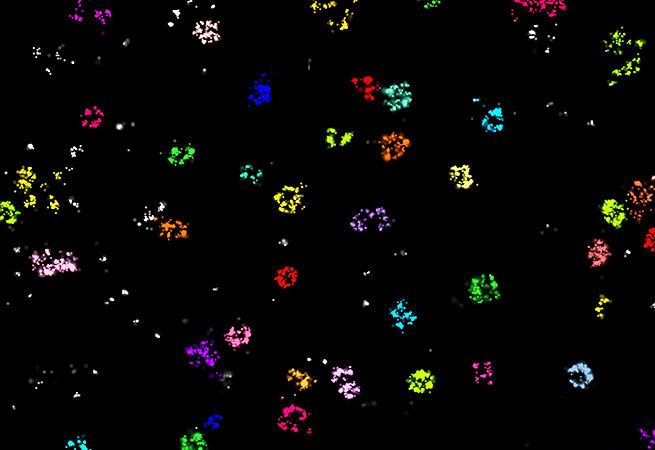
14. Видим яснее
Marie-Cecile Didiot, Anastasia Khvorova Lab
RNA Therapeutics Institute, UMass Medical School
Последние достижения технологии микроскопии сегодня позволяют визуализировать буквально любую молекулу РНК. Такой метод называется "RNAscope" и представляет собой высокочувствительный метод гибридизации in situ. Исследователи из Лаборатории Хворовой используют эту технологию для определения локализации специфических мРНК при различных нейродегенеративных заболеваниях.
Изображение: Визуализация мРНК Hprt в первичных нейронах с использованием конфокального микроскопа (ядро — синий, мРНК Htt — зеленый, мРНК Hprt — красный).
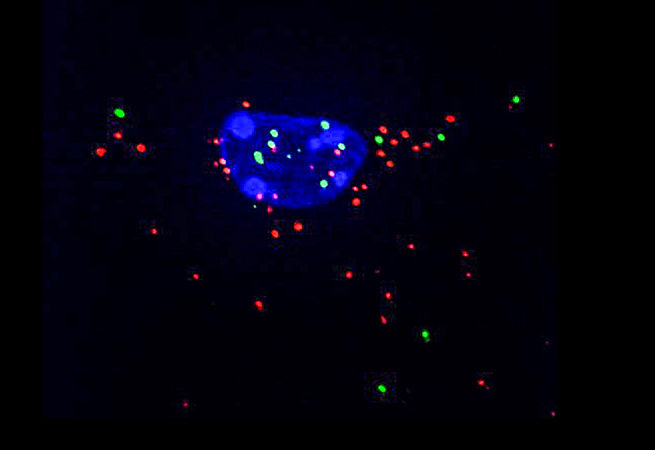
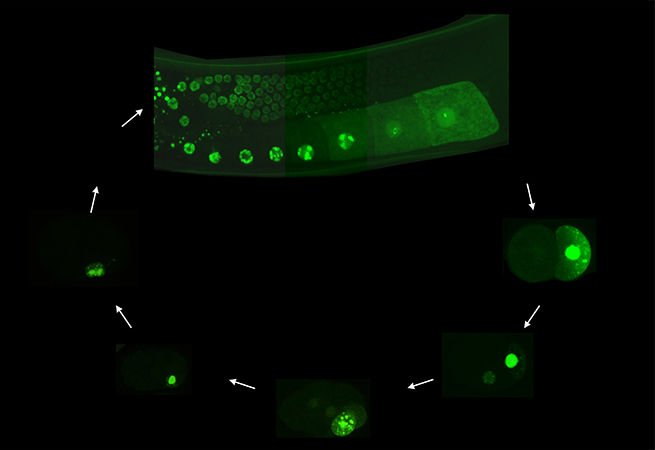
15. Светящийся червь
HeeSun Kim, Craig Mello Lab
RNA Therapeutics Institute, UMass Medical School
Червячка-нематоду C. elegans используют в качестве модельного организма для исследования дифференцировки и коммуникации эмбриональных клеток в ходе развития. Внедрение кодирующей последовательности зелёного флуоресцентного белка в локус pie-1 генома нематод с помощью технологии CRISPR/Cas9 позволяет визуализировать гонады взрослых и эмбриогенез в ходе жизни C. elegans.
Изображение: PIE-1 экспрессируется во время пахитены (мейоза зародышевых клеток) и после оплодотворения во время эмбриогенеза распределяется между бластомерами зародышевой линии (P1, P2, P3 и P4) и двумя дочерними клетками P4 (Z2/Z3, первичные зародышевые клетки). Штамм PIE-1::GFP был создан с помощью CRISPR/Cas9-опосредованной гомологичной рекомбинации: кодирующая последовательность gfp (зелёного флуоресцентного белка) встраивалась в эндогенный локус pie-1 непосредственно перед стоп-кодоном. Изображения получены с помощью сканирующего блока конфокальной системы, установленного на инвертированном микроскопе с объективом 40×.
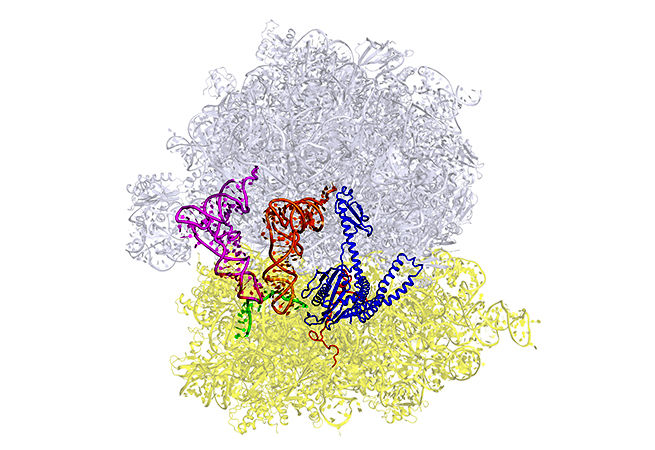
16. Спасти рибосомы
Gabriel Demo, Andrei Korostelev Lab
RNA Therapeutics Institute, UMass Medical School
Рибосомы часто считают молекулярными фабриками клетки, которые расшифровывают инструкции, закодированные в РНК и "переводят" их в белок. Рибосома, осуществляющая трансляцию, распадается либо доходя до конца цепи мРНК, либо из-за клеточного стресса, преждевременного прекращения транскрипции, расщепления мРНК или в результате других причин. Лаборатория Коростелева работает над выяснением механизма спасения рибосом от разрушения и повторного их применения для трансляции.
Изображение: Крио-ПЭМ (просвечивающая электронная микроскопия) с разрешением 3.2 Å структуры субъединицы 70S рибосомы E. coli, связанной с ArfA и рилизинг-фактором RF2.
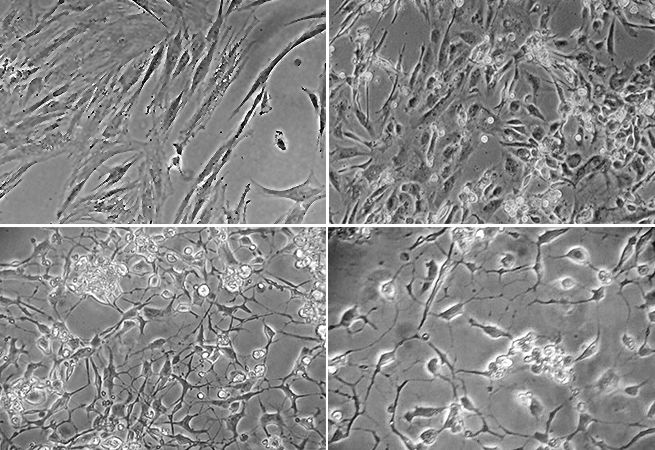
17. Превратим кожу в клетки мозга?
Marie-Cecile Didiot, Anastasia Khvorova Lab
RNA Therapeutics Institute, UMass Medical School
Проблемой исследований нейродегенеративных заболеваний остаётся нехватка доступных для экспериментов образцов от пациентов. Одним из способов борьбы с этой проблемой исследователи из Лаборатории Хворовой называют применение способности клеток кожи (фибробластов) пациентов с болезнью Гентингтона к трансформации в клетки головного мозга (нейроны), подходящие для изучения заболевания.
Изображение: Световая микроскопия фибробластов, перепрограммированных путём гиперэкспрессии miR-9 и miR-124, а также четырёх нейрональных транскрипционных факторов для запуска преобразования в нервные клетки. Изображения показывают трансформацию по дням: 0 (вверху слева), 9 (вверху справа), 19 (внизу слева) и 26 (внизу справа). На 26 день наблюдается полная трансформация нейронов. Протокол, основанный на статье Richner et al., (2015).