Курение и кожа
Перевод: Антон Желонкин
Редакция: Алиса Скнар, Телли Мурадова, Михаил Гусев
Оформление: Cornu Ammonis
Публикация: 09.06.2018

Абстракт | Курение сигарет неразрывно связано с серьезной патологией всех систем организма человека, и кожные покровы — не исключение. Предмет этого обзора — вред, который приносит коже потребление табака. Важно определить разницу между эффектами табакокурения и собственным влиянием никотина на кожу. Все клетки кожи экспрессируют несколько подтипов никотиновых ацетилхолиновых рецепторов (нХР), включая рецептор подтипа α7. На одни хронические дерматозы курение влияет отрицательно, на другие — положительно. Выявив отрицательное влияние курения на определенное заболевание, пациентам можно рекомендовать отказ от него, а в противоположных случаях — разработать терапевтические агенты на основе агонистов нХР.
Токсичные составляющие табачных изделий
Курение сигарет неразрывно связано с серьезной патологией всех систем организма человека, и кожные покровы — не исключение. Несмотря на попытки предостеречь население от опасностей курения, оно сохраняет лидирующие позиции в качестве одной из причин предотвратимой смертности. Табакокурение известно в Европе с тех пор, как Христофор Колумб в 1492 г. заметил, как индейцы Араваки курили листья табака. Растение табака назвали Nicotiana tabacum в честь французского посла в Португалии, который приобщил Францию к этому растению — Жана Нико (Jean Nicot). Никотин — основной алкалоид табака — был выделен в 1828 г. Никотин может проникать в организм человека при попадании дыма в легкие или желудочно-кишечный тракт, а также в составе интраназальных спреев, трансдермальных пластырей, кремов для местного применения или клизм. Небольшие количества никотина обнаруживаются в пищевых продуктах, таких как помидоры, картофель и баклажан. Никотин может всасываться в кровоток через ротовую полость, легкие, мочевой пузырь, желудочно-кишечный тракт и через кожу. От 70 до 80 % никотина, всасывающегося в желудочно-кишечном тракте, при первом прохождении через печень превращается в его наиболее важный метаболит — котинин [1]. Скорость всасывания никотина через кожу и слизистые находится в прямой зависимости от его концентрации. Период полувыведения никотина составляет приблизительно два часа [2].
С точки зрения дерматологии употребление табака несет в себе много опасностей для кожи, которые могут реализоваться как через прямое влияние на эпидермис, так и опосредованно — через кровоток. Табачный дым состоит из твердой дисперсной фазы, к которой относится и его основной алкалоид — никотин, а также летучей фазы. В нем содержится много мутагенов и канцерогенов, в частности, полициклические ароматические углеводороды (ПАУ), нитрозамины и гетероциклические амины. Основные токсические компоненты твердой фазы включают в себя никотин, фенол, катехол, хинолин, анилин, толуидин, никель, N-нитрозодиметиламин, бензапирены, бензантрацен и 2-нафтиламин. Основные токсические компоненты газовой фазы — углекислый газ, угарный газ, циановодород, оксид азота, ацетон, формальдегид, акролеин, катионы аммония, пиридин, 3-винилпиридин, N-нитрозодиметиламин и N-нитрозопирролидин. Исследования экспрессии генов в клетках кожи показали, что компоненты табака активируют экспрессию 14 различных генов, участвующих в метаболизме ксенобиотиков и ответе на окислительный или иной стресс [3]. Негеномные эффекты табачного дыма обусловлены образованием активных форм кислорода (АФК). Никотин и его метаболиты влияют на кожу посредством активации никотиновых холинорецепторов (нХР), экспрессируемых эпителиоцитами [4].
Признаки курения на слизистых оболочках и коже
Заядлых курильщиков, как правило, можно определить по характерным проявлениям на коже и слизистых оболочках. Часто обнаруживают желтое окрашивание светлых усов и ногтей, пропитанных побочными продуктами табака. При прекращении курения между дистальной пигментированной частью ногтя и растущим нормальным ногтем появляется различимая граница — явление, известное как ноготь Арлекина или ноготь «бросающего» (Рис. 1). По длине выросшего нормального ногтя можно предположить, как долго человек не курит. Хроническое нагревание от зажженной сигареты также окрашивает кончики пальца за счет поствоcпалительной гиперпигментации. У одной трети курильщиков заметна периоральная гиперпигментация [5]. У детей, пассивно вдыхающих табачный дым [6], а также употребляющих никотин сублингвально, можно обнаружить пигментацию десен [7]. Пигментация десен обусловлена образованием гранул меланина, синтезирующихся в меланосомах. Никотин, который может выступать предшественником синтеза меланина, способен необратимо связываться с меланином и накапливаться в меланин-содержащих тканях [8]. Известно, что и другие компоненты табака, в особенности такие канцерогены, как N`-нитрозонорникотин (NNN), 4-(метилнитрозамино)-1-(3-пиридил)-1-бутанон (NNK) и бензапирен, накапливаются в тканях, содержащих меланин [9].
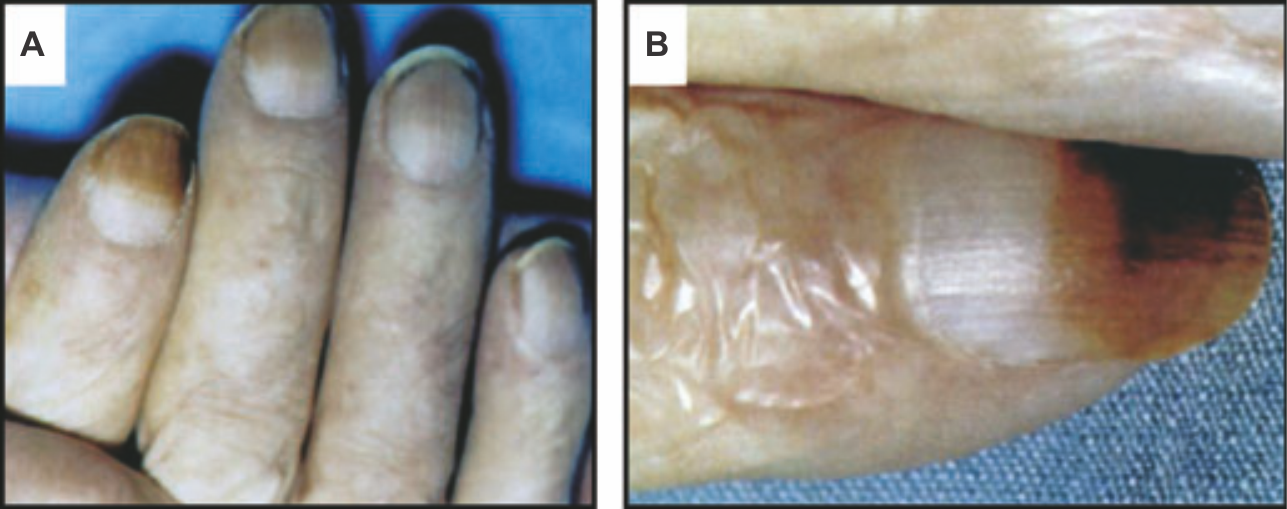
Рисунок 1 | Ноготь Арлекина или «того, кто пытается слезть»
(а) Окрашивание никотином и демаркационная линия на нескольких пальцах.
(b) Демаркационная линия между дистальной пигментированной частью ногтя и вновь образующейся проксимальной розовой частью ногтя появилась после резкого прекращения курения.
Курение может оказывать влияние и на язык, нёбо и другие анатомические образования ротовой полости. У курильщиков можно обнаружить характерную гиперплазию сосочков и черную пигментацию дорсальной поверхности языка, т. н. «черный волосатый» язык. Язык курильщика (или никотиновая лейкоплакия языка, leukokeratosis nicotina glossi) — однородный кератоз с воспаленными слюнными железами, которые выглядят как папулы с углублением по середине. У курильщиков биди (табака, завернутого в лист Кромандельского черного дерева) встречается центральная атрофия сосочков языка, обратимая при прекращении курения. Небо курильщика (или никотиновая лейкоплакия неба, leukokeratosis nicotina palati) — бессимптомный однородный кератоз задних двух третей твердого неба в сочетании с множественными красными вдавленными посередине папулами, представляющими собой воспаленные слюнные железы. Встретить такое можно исключительно у курильщиков, особенно у заядлых любителей трубки. С другой стороны, у любителей пожевать табак появляется белое окрашивание в месте соприкосновения с табаком, которое может изъязвляться (Рис. 2)
(b) Демаркационная линия между дистальной пигментированной частью ногтя и вновь образующейся проксимальной розовой частью ногтя появилась после резкого прекращения курения.
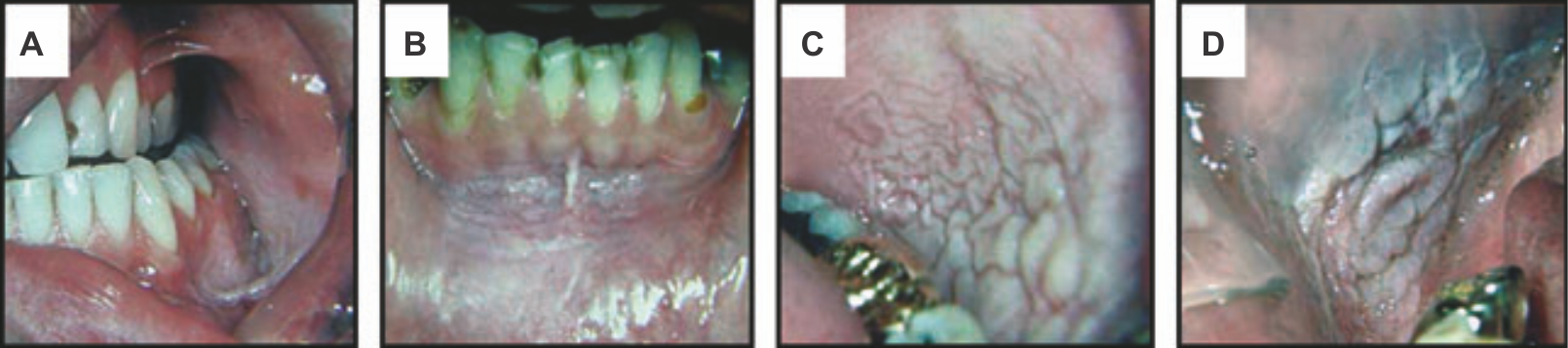
Рисунок 2 | Кератоз, вызванный употреблением жевательного табака (бездымный табачный кератоз)
Гиперкератоз различной степени выраженности развился на месте соприкосновения слизистой оболочки с табаком.
Степень 1 (а) слизистая оболочка нормального цвета с небольшими поверхностными морщинками. Морщинки исчезают при натяжении слизистой оболочки.
Степень 2 (b)сочетание бело-серых и красноватых участков с умеренно выраженными морщинами. При натяжении ни морщины, ни цвет не пропадают. Обращает внимание различная толщина морщин более тяжелой 2 (c) степени.
Степень 3 (d) по цвету сходна с более тяжелой 2-й степенью (бело-серый и красноватый), но на слизистой оболочке видны глубокие толстые морщины, не исчезающие при натяжении.
Чем более давняя привычка, тем выше степень. У пациента на фото (d) есть зона изъязвления в верхней части участка слизистой оболочки, контактирующей с табаком. Отказ от привычки, особенно при условии ее небольшой продолжительности, приводит к регрессии повреждений.
Степень 1 (а) слизистая оболочка нормального цвета с небольшими поверхностными морщинками. Морщинки исчезают при натяжении слизистой оболочки.
Степень 2 (b)сочетание бело-серых и красноватых участков с умеренно выраженными морщинами. При натяжении ни морщины, ни цвет не пропадают. Обращает внимание различная толщина морщин более тяжелой 2 (c) степени.
Степень 3 (d) по цвету сходна с более тяжелой 2-й степенью (бело-серый и красноватый), но на слизистой оболочке видны глубокие толстые морщины, не исчезающие при натяжении.
Чем более давняя привычка, тем выше степень. У пациента на фото (d) есть зона изъязвления в верхней части участка слизистой оболочки, контактирующей с табаком. Отказ от привычки, особенно при условии ее небольшой продолжительности, приводит к регрессии повреждений.
Преждевременное старение кожи
Одно из наиболее характерных и общественно значимых проявлений курения — преждевременное старение. «Лицо курильщика» типично испещрено выраженными морщинами, черты лица истончаются, подчеркивая костный рельеф, кожа атрофичная с сероватым оттенком на фоне полнокровия [10]. Степень изменений напрямую связана с количеством выкуриваемых за день сигарет (Рис. 3).
У женщин преждевременное старение выражено сильнее, чем у мужчин. Выраженность морщин усиливается за счет прямого контакта с сигаретным дымом, который высушивает роговой слой эпидермиса и вызывает умеренную воспалительную реакцию [12]. Эксперименты на мышах in vivo также показывают, что пассивное воздействие табачного дыма приводит к преждевременному старению кожи [13]. Кожа, которая подвергается влиянию табачного дыма, тонкая и хрупкая, склонна провисать. В то время как табакокурение само по себе является независимым фактором риска образования морщин, инсоляция усиливает этот эффект [14]. Курение поражает и закрытую от солнца кожу. Наилучшими предикторами степени старения являются количество сигарет, выкуриваемых в день, и возраст.
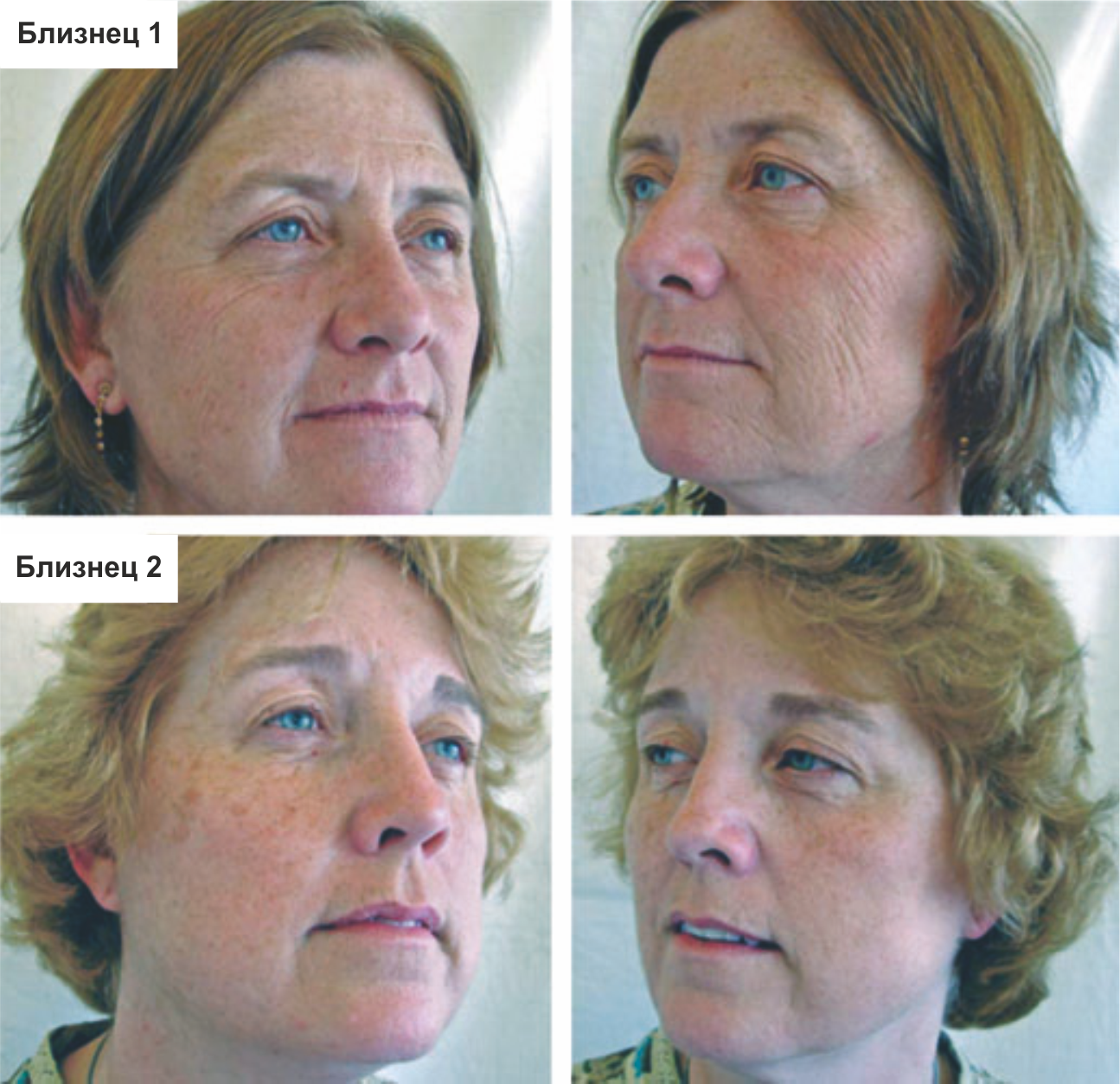
Рисунок 3 | Проявления курения на лице у курящей близнеца
Обращают на себя внимание значительные отличия внешности курящей близнеца 1 в сравнении с некурящей близнецом 2. У близнеца 1, по данным анамнеза, около 52,5 пачка/лет (количество пачек сигарет, выкуриваемых в день, помноженное на общую продолжительность курения в годах). Суммарная инсоляция на протяжении жизни у близнецов сопоставима.
Сигаретный дым — важный фактор ускорения процессов старения за счет образования свободных радикалов и развития соответствующих патологических процессов (Рис. 4). Курение может приводить к изнашиванию механизмов клеточной защиты и репарации, что ведет к накоплению повреждений, связанных с мутациями и дефектными белками. Курение также нарушает обновление межклеточного вещества в коже [17], что приводит к дисбалансу между процессами синтеза и деградации белков соединительной ткани дермы. Помимо того, что курение снижает синтез коллагенов типа I и III (важное условие ускоренного старения кожи) [18], оно также увеличивает содержание тропоэластина и ускоряет деградацию коллагена [19]. Курение — самостоятельный фактор риска увеличения количества эластических волокон сосочкового слоя дермы в коже, не подверженной прямому контакту. Такой прирост — следствие нарастающей деградации эластического вещества, аналогично солнечному эластозу [20].
Нарушения в межклеточном веществе соединительной ткани могут вносить свой вклад в молекулярные механизмы преждевременного старения кожи у курильщиков. Эксперименты in vitro показывают, что биосинтез коллагена в культуре фибробластов значительно снижается после воздействия экстракта табачного дыма [18]. Курение повышает экспрессию металлопротеиназ матрикса (MMP-1, MMP-2, MMP-3, MMP-7, and MMP-8) [17,19]. В коже курильщиков по сравнению с некурящими повышена экспрессия MMP-8, а TIMP-1 — ингибитора MMP, — снижена. Повышенная экспрессия MMP-1 у активных курильщиков определяется и в закрытых от солнца участках кожи. Эксперименты in vitro показали, что экстракт табачного дыма может усиливать экспрессию MMP-1 и MMP-3 в фибробластах дермы. Более того, экспрессия MMP-1 существенно увеличивается в фибробластах после стимуляции экстрактом табачного дыма и облучением ультрафиолетом UVA1, вне зависимости от друг друга [18].
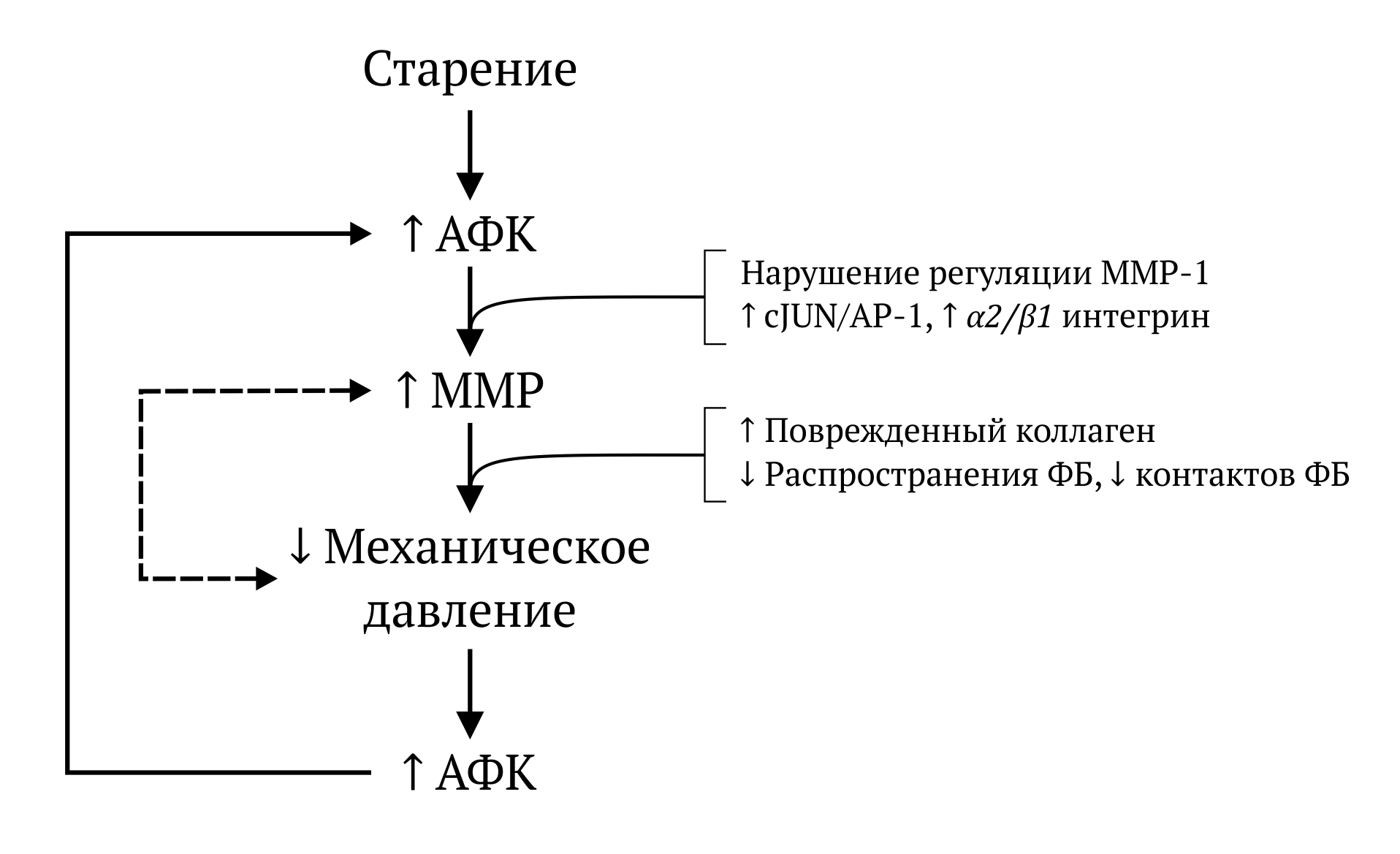
Рисунок 4 | Механизм преждевременного старения, обусловленного курением
Курение увеличивает количество АФК и MMP, что ведет к деградации коллагена и нарушению структурной целостности межклеточного матрикса. Такое сниженное механическое давление на фибробласты приводит к увеличению внутриклеточного уровня оксидантов — это, в свою очередь, стимулирует экспрессию MMP-1 еще более. ФБ — фибробласты; АФК — активные формы кислорода.
Трансформирующий фактор роста (TGF)-b1, вероятно, играет роль в возрастных изменениях кожи, связанных с табакокурением. Табак блокирует ответ клеток на TGF-b, благодаря отрицательной регуляции рецептора TGF-b1 и индукции нефунционирующих его форм, что указывает на роль модуляции TGF-b1 в качестве возможного способа торможения преждевременного старения кожи [22].
Никотин может нарушать ремоделирование дермы за счет увеличения активности регуляторов клеточного цикла, апоптоза и количества коллагена Ia1, эластина и MMP-1 [23]. Изменяя метаболизм межклеточного вещества и экспрессию нХР, он может влиять на физиологическое старение. Никотин также способствует гиперпродукции эластина и гиперэкспрессии нХР-α7 кератиноцитов. Однако никотинергическое влияние на фибробласты дермы в основном опосредовано подтипом нХР-а3 [24].
Рак кожи
В ходе эпидемиологических исследований выявлены как положительные, так и отрицательные взаимосвязи между курением, заболеваемостью и агрессивностью определенных типов рака кожи. Развитие индуцированного курением рака кожи объясняют следующими механизмами: ускоренное старение, мутагенез, стимуляция роста и инвазии опухолевых клеток, неоваскуляризация и ремоделирование стромы. Несмотря на то, что есть исследования, в которых не обнаружили никакой взаимосвязи с курением, [25] большинство работ установили, что курение — независимый фактор риска развития плоскоклеточного рака (ПР), в частности, ПР пениса, вульвы, шейки матки и ануса [26]. Прекращение табакокурения приводит к снижению этих рисков [27]. Курение увеличивает заболеваемость высокоагрессивными формами ПР вульвы и снижает выживаемость. Курящие женщины с генитальными бородавками в 35 раз сильнее подвержены развитию рака вульвы, что предполагает наличие синергии между курением и генитальными бородавками [27]. Также установлена достоверная взаимосвязь злокачественных новообразований ротовой полости с курением [28]. Курение сигарет без фильтра еще больше увеличивает риск [29]. Курящие женщины особенно подвержены ПР ротовой полости [30].
Большинство исследований не нашли четкой ассоциации между курением и риском базально-клеточного рака (БКР) [26], но данные противоречивы. Курение сигарет, возможно, связано с преобладанием больших по размеру БКР (>1 см в диаметре) [31] и более агрессивных форм [32].
Более ранние исследования, в которых изучалась взаимосвязь курения и меланомы, выявили, что количество курящих мужчин в ремиссии через пять лет после постановки диагноза значительно меньше, чем некурящих [33]. У курильщиков выше вероятность раннего и висцерального метастазирования [34]. Более поздние исследования, однако, показывают, что привычка курить никак не влияет на риск злокачественного течения меланомы [26]. Многолетнее курение даже может снизить риск развития меланомы, особенно акральной меланомы [35]. Защитный эффект курения относительно кожной меланомы может быть связан с участием никотина в синтезе меланина, его аффинитетом к меланин-содержащим тканям, необратимым связыванием с меланином и депонированием канцерогенов табака NNK и NNN в тканях, содержащих меланин. Примечательно, что на примере бесшерстных мышей было показано ингибирующее влияние компонентов табака, обусловленное блоком сигнального пути ядерного фактора-jB, на индуцируемые облучением UVB опухоли кожи [13].
Курение связано со сниженным риском классической саркомы Капоши (кСК) [36] и СПИД-ассоциированной саркомой Капоши. Однако в ходе клинических испытаний трансдермальный никотин в лечении кСК у некурящих оказался неэффективным относительно очагов кСК или вирусной нагрузки HHV-8 [38]. Канцерогенность табака в основном связана с действием ПАУ, нитрозаминов и гетероциклических аминов. Известно, что курение замедляет репарацию одноцепочечных разрывов ДНК [39], а также оказывает прямой онкогенный эффект [40]. Проонкогенный эффект никотина также объясняется увеличением частоты митозов клеток базального слоя и появлением гипертрофированных эпителиальных клеток в эпидермисе [41]. Никотин и нитрозамин, содержащиеся в табаке, способствуют росту опухолей благодаря положительной регуляции клеточных нХР, что индуцирует инвазию злокачественных клеток и ингибирует апоптоз [42]. Проинвазивные эффекты никотина обусловлены нХР-α7 [43]. Никотин увеличивает секрецию ацетилхолина, а также экспрессию и активность нХР в злокачественных клетках [44]. Рецептор‑опосредованная токсичность табака — результат взаимодействия нисходящих сигнальных путей Ras/Raf‑1/MEK1/ERK, а также JAK-2/STAT-3, начинающихся с активации нХР‑α7 кератиноцитов (Рис. 5) [45]. Также доказано, что никотин стимулирует рост опухолей за счет увеличения активности phospho-ERK (фосфорилированная киназа, регулируемая внеклеточными сигналами). Пролиферативные эффекты никотина можно предотвратить при помощи высокоаффинного блокатора нХР‑α7 — α‑кобратоксина [46]. Фармакологический блок нХР-α7 растормаживает апоптоз и снижает экспрессию фактора роста эндотелия сосудов (VEGF) — это приводит к ингибированию ангиогенеза [47].
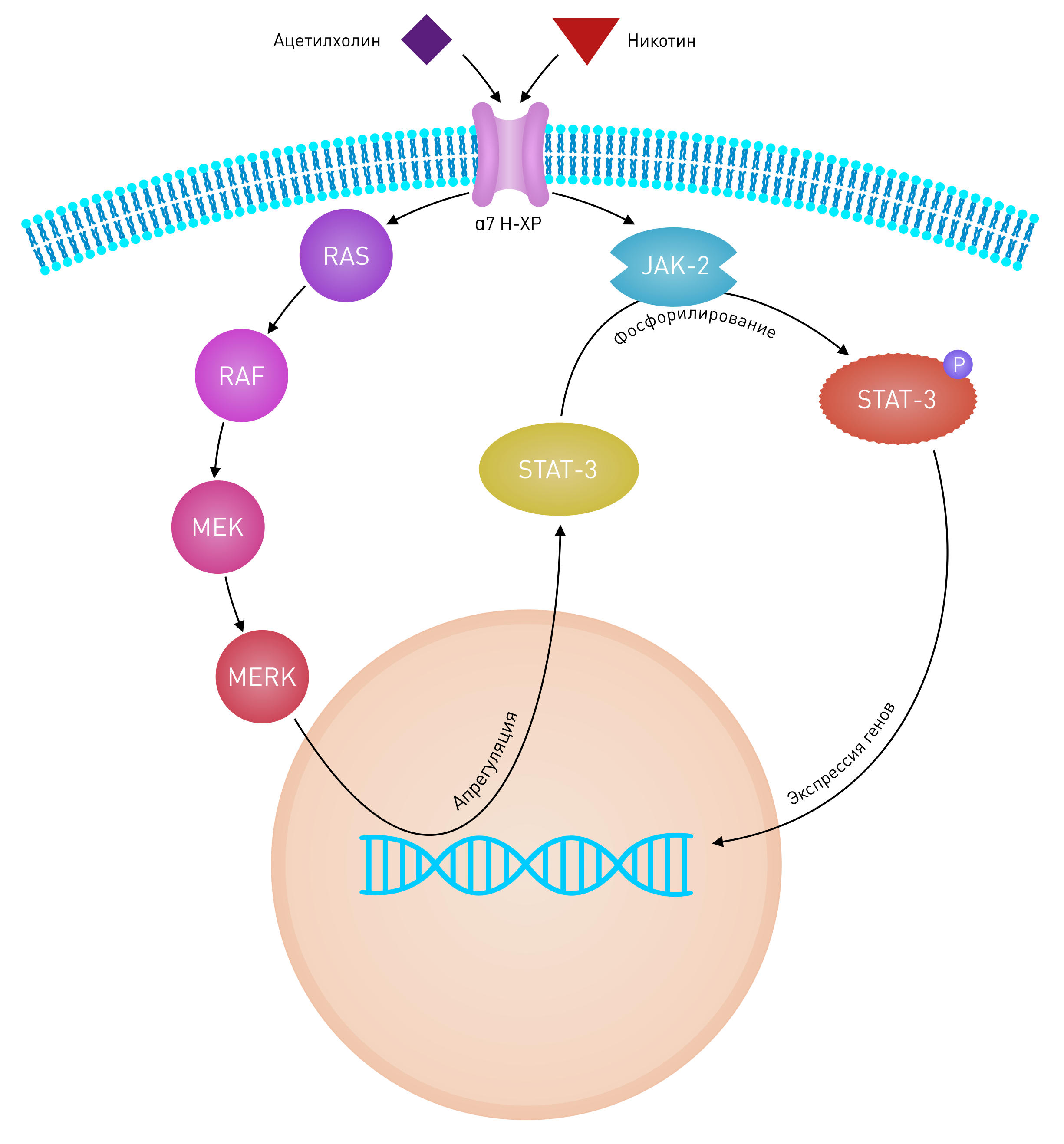
Рисунок 5 | Взаимодействие нисходящих сигнальных путей Ras/Raf/MEK/ERK и JAK-2/STAT-3 с нХР-α7 кератиноцитов
Стимуляция нХР-α7 как физиологическим лигандом — ацетилхолином, так и никотином ведет к изменению в экспрессии гена посредством трансактивации STAT-3. Трансактивация может происходить через два сигнальных пути, сопряженных с нХР-α7. Путь последовательной активации Ras/Raf/MEK/ERK приводит к увеличению концентрации STAT-3 в цитоплазме, благодаря положительной регуляции экспрессии, тогда как активация тирозин киназы JAK-2 обусловливает фосфорилирование STAT-3 с последующей транслокацией димеров STAT-3 в ядро, где и произойдет изменение экспрессии гена.
Известны также и непрямые онкогенные эффекты никотина, связанные с эндотелиальными клетками и фибробластами дермы. Никотин может усилить рост опухоли за счет усиления опухолевой васкуляризации и создания про‑канцерогенной среды в строме [49]. Воздействие экстракта бездымного табака на дермальные фибробласты усиливает выработку факторов, ускоряющих пролиферацию и прорастание иммортализированных кератиноцитов. Таким образом, ультрафиолет и нитрозамины табака могут индуцировать канцерогенез, тогда как никотин способствует росту и распространению измененных клеток.
Нарушение заживления ран
У курильщиков повышен риск осложнений операционных ран [50]. Исследования на животных показали, что курение в течение восьми недель до хирургической операции увеличивает вероятность некроза кожного лоскута [51]. В то же время, воздержание от курения снижает вероятность инфекционных осложнений [52].
Патобиологические основы изменения заживления ран под действием табака сходны с таковыми при преждевременном старении кожи. Например, также снижается выработка коллагена и изменяется метаболизм межклеточного вещества с увеличением уровней MMP-8. Показано, что это способствует нарушению процессов регенерации. Вероятно, курение также влияет на заживление ран за счет ингибирования миграции фибробластов к раневому ложу, что ведет к их накоплению по краю раны. Увеличение продолжительности жизни фибробластов одновременно со снижением их миграции может способствовать фиброзированию и чрезмерному рубцеванию [54]. Важно, что эпителизация раны обусловливается миграцией кератиноцитов поверх обнаженной дермы. Миграция кератиноцитов регулируется как никотиновыми, так и мускариновыми подтипами ХР. Ее можно ингибировать при помощи активации нХР-α7, которые ответственны за сопряжение ионных потоков с каскадами протеинкиназных сигнальных путей, регулирующих экспрессию интегрина и активность Rho-киназы [55–58].
Курение может замедлять заживление ран опосредованно через замедление кровотока. В то время, как курение снижает объемный кровоток, концентрацию кислорода и активность аэробного метаболизма в коже, никотин сам по себе увеличивает содержание кислорода в тканях, даже несмотря на сниженный кровоток [59]. Скорее всего, влияние курения на микроциркуляцию обусловлено не воздействием никотина. Вероятно, никотин оказывает влияние на регенерацию только в токсических дозах. В терапевтическом диапазоне, однако, трансдермальный никотин показал себя с другой стороны: он нормализует микрососудистую перфузию кожи пальцев [60] и стимулирует заживление ран и ангиогенез [61]. В эксперименте на мышах никотин значимо способствовал регенерации [62]. Помимо положительной регуляции темпа эпителизации, механизм, вероятно, связан с усиленным синтезом коллагена типа I [63].
Хронические дерматозы, на которые влияет курение
Контактный дерматит
Курение сигарет и употребление нюхательного табака — доказанные факторы риска развития аллергического контактного дерматита. В сигаретах обнаруживают следующие аллергены: какао, ментол, лакрица, канифоль и формальдегид [64]. Курение дозозависимо повышает вероятность положительной накожной пробы на никель [65]. Никотин, сам выступая аллергеном, в кожных пробах может вызывать аллергический или простой контактный дерматит на месте аппликации [66].
Атопический дерматит
Хотя у курящих людей титр IgE в сыворотке значительно выше, чем у некурящих, сведения относительно влияния курения на атопический дерматит противоречивы. В одних исследованиях докладывают, что курение — независимый фактор риска экземы кистей [68]. Однако другие исследования такой взаимосвязи между курением и атопическим дерматитом или экземой кистей не выявили [69].
Псориаз
Хороша известна значительная прямая корреляция между псориазом и курением, зависящая от количества сигарет, выкуриваемых в день [69]. Курение — независимый фактор риска псориаза [70], более опасный у мужчин [71]. Более того, периоды ремиссии после лечения у курильщиков короче [72].
Ладонно-подошвенный пустулез (ЛПП)
ЛПП (Рис. 6) — одно из наиболее распространенных воспалительных заболеваний кожи, связанное с курением. Около 95 % всех больных ЛПП — курильщики, большинство — заядлые [73]. Прекращение табакокурения значительно улучшает состояние: меньше пустул, меньше площадь эритемы с шелушением [74]. Мишень воспаления при ЛПП — акросирингиум (Интраэпидермальная часть протока потовой железы — прим. ред.). Из-за нарушенной экспрессии нХР и других компонентов холинергической системы кожи у пациентов с ЛПП может развиваться аномальная воспалительная реакция на никотин. Эти наблюдения указывают на роль никотина в патогенезе ЛПП [75].
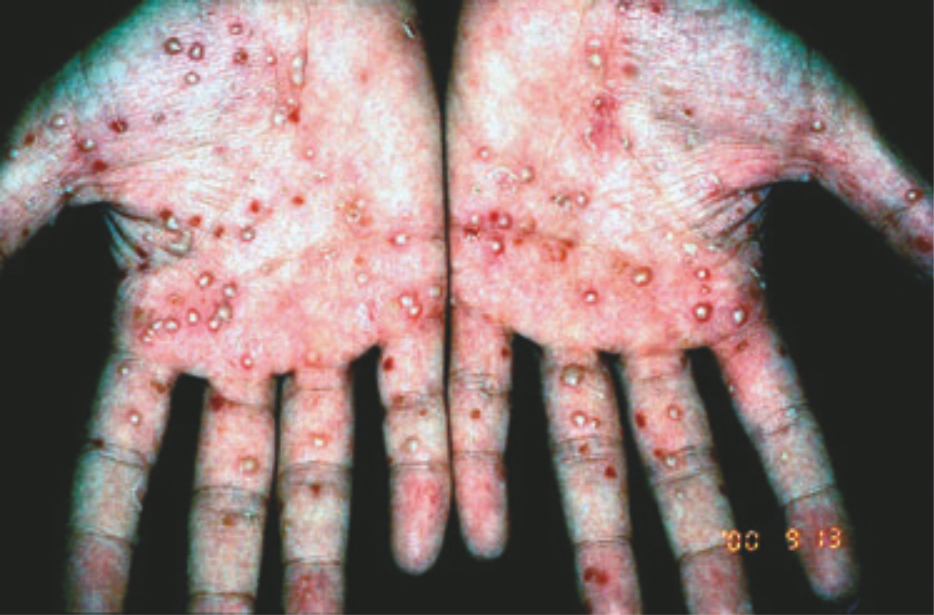
Рисунок 6 | ЛПП, также известный как «пустулезный псориаз»
Кожная красная волчанка
Исследования выявили статистически значимую связь между активным курением и развитием кожной красной волчанки [76]. Также была показана связь дискоидной красной волчанки (ДКВ) и курения. У курильщиков с ДКВ более обширные поражения при дебюте заболевания [77]. Также эффективность терапии антималярийными препаратами снижается при курении [78].
Болезни волос и волосяных фолликулов
Курение связано с преждевременным поседением волос как у мужчин, так и у женщин, а также с более ранней потерей волос у мужчин [79]. Течение андрогенетической алопеции при частом курении усугубляется, а дебют происходит тем раньше, чем выше доза [80]. Исследования in vivo показали, что у мышей, подвергшихся воздействию табака, развивается атрофия эпидермиса, истончается подкожная жировая клетчатка, количество волосяных фолликулов уменьшается. Также в луковице волоса наблюдается клеточный апоптоз [81]. Курение влияет на микроциркуляторное русло волосяного сосочка в дерме и приводит к повреждению ДНК клеток волосяного фолликула [82]. Оно также выводит из равновесия систему протеаз-антипротеаз, что ведет к изменениям в цикле роста волос. Увеличение концентрации провоспалительных цитокинов вызывает микровоспаление и фиброз фолликулов.
Пустулезные дерматозы
В то время, как одни исследования говорят о дозозависимой линейной связи заболеваемости и тяжести вульгарного акне с табакокурением [83], другие работы такой взаимосвязи не выявили [84]. Напротив, докладывают о более низкой распространенности акне среди курильщиков [85]. Риск развития розацеа среди курильщиков также ниже, вероятно, вследствие сосудосуживающего действия курения [86]. Установлена четкая взаимосвязь курения с гнойным гидраденитом (т. н. инверсные угри) [87]. Ключевым звеном патогенеза гнойного гидраденита, вероятно, выступают холиночувствительные клетки не‑нервного происхождения, о чем говорит аномальная экспрессия нХР в вовлеченной в процесс коже [88].
Пузырные дерматозы
В литературе отмечают, что при курении вульгарная пузырчатка протекает благоприятнее. Это согласуется с данными о том, что среди больных пемфигусом курильщики составляют меньшую часть [89]. Курильщики с вульгарным пемфигусом выходят в частичную и полную ремиссию чаще некурящих [90]. Также существует обратная связь табакокурения с герпетиформным дерматитом и с ассоциированной целиакией [91]. У курильщиков с недавно выявленной целиакией реже обнаруживают антитела к эндомизию, чем у некурящих [92]. Однако в одном исследовании не обнаружили какой-либо взаимосвязи курения с наличием антиглиадиновых антител [93]. Значимой взаимосвязи между курением и пемфигоидом слизистых оболочек не обнаружили [94].
Язвы кожи
Курение — фактор риска развития пролежней [95] и инфицированных язв у пациентов с диабетом [96]. Более 90 % пациентов с язвенными поражениями вследствие болезни Бюргера (облитерирующий тромбангиит) — курильщики. Длительные ремиссии возможны при прекращении табакокурения, тогда как рецидивы обусловлены возвращением ко вредной привычке [97].
Вирусные заболевания кожи
Известно, что курение увеличивает риск возникновения генитальных бородавок у мужчин [98]. А вот заболеваемость рецидивирующим герпесом губ у курильщиков, напротив, значительно ниже, особенно при курении трубки [99]. Скорее всего это связано со способностью табака ингибировать репликацию вируса простого герпеса и значительно снижать его цитолитический эффект [100]. Однако более свежие исследования показали, что аппликации никотина через трансдермальный пластырь индуцируют реактивацию вируса простого герпеса, а также вирусовыделение у кроликов-носителей инфекции [101].
Другие заболевания кожи и слизистых оболочек
Значимая связь установлена между курением и диабетическим липоидным некробиозом [102]. Курение также связывают с генерализованной крапивницей [103]. У мужчин, курящих сигареты или биди, риск развития повреждений кожи, связанных с действием мышьяка, значительно выше, чем у некурящих [104]. С другой стороны, существует обратная связь табакокурения с географическим языком [105].
Заболевания кожи, в лечении которых используют никотин
Как уже было отмечено выше, курение может усугублять течение некоторых заболеваний, способствовать канцерогенезу и потенциально ведет к зависимости. Однако, как бы это ни было парадоксально, в случае многих дерматологических заболеваний никотин показывает себя эффективным средством монотерапии. Болезнь Бюргера четко ассоциирована с курением, но ее успешно лечат при помощи жевательной резинки, содержащей никотин (Рис. 7) [106]. Вероятно, другие компоненты табака индуцируют спазм сосудов и утяжеляют течение облитерирующего тромбангиита, однако использование никотина может обладать ценным терапевтическим потенциалом. Помимо этого, ключевым компонентом лечения болезни Бюргера является отказ от курения.
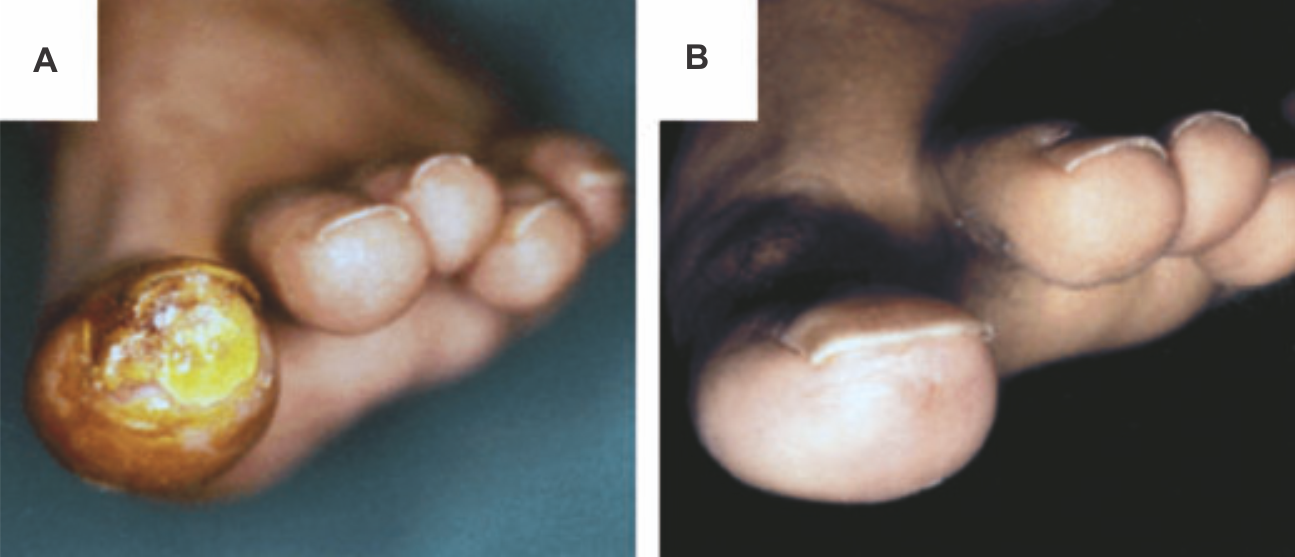
Рисунок 7 | Болезнь Бюргера на фоне лечения никотином
(а)Левый большой палец ноги с большой глубокой язвой (1,5–2,0 см) у 38-летнего мужчины, который курит 20 лет.
(b) Язва зажила через 20 дней после начала лечения никотиновой жевательной резинкой (2 мг на штуку), назначенной по два раза в день. По крайней мере 14 месяцев спустя на фоне приема 2 никотиновых жвачек в день без других препаратов ноги пациента оставались в хорошем состоянии: без язв или перемежающейся хромоты.
Также известно о терапевтическом эффекте курения сигарет на афтозные язвы слизистой оболочки ротовой полости и гениталий при болезни Бехчета [107]. Соответствующим образом, прекращение курения ведет к появлению кожно-слизистых проявлений, особенно афтозного стоматита. Однако при лечении никотином афтозные язвы регрессируют в течение нескольких дней [108]. Механизм такого действия, вероятно, связан со способностью никотина ингибировать высвобождение провоспалительных цитокинов IL-6 и IL-8 из кератиноцитов и эндотелиальных клеток в дерме. Экстракт табачного дыма также снижает выброс IL-8, но увеличивает выработку VEGF кератиноцитами человека [109].
(b) Язва зажила через 20 дней после начала лечения никотиновой жевательной резинкой (2 мг на штуку), назначенной по два раза в день. По крайней мере 14 месяцев спустя на фоне приема 2 никотиновых жвачек в день без других препаратов ноги пациента оставались в хорошем состоянии: без язв или перемежающейся хромоты.
Воспалительные заболевания кишечника (ВЗК), по данным эпидемиологов, связаны с курением [110]. Курение и/или употребление чистого никотина может влиять на такие проявления ВЗК на слизистых оболочках и коже, как афтозный стоматит, гангренозная пиодермия и узловатая эритема. Большинство пациентов с неспецифическим язвенным колитом — некурящие либо прекратившие курение [111]. Прекращение курения усугубляет прогрессирование неспецифического язвенного колита (НЯК), но прогрессия замедляется вновь при возобновлении курения. Напротив, курящие пациенты с болезнью Крона склонны к более тяжелому течению [112]. Никотин — ключевой компонент табака, оказывающий влияние на ВЗК, ведь известно, что его введение через трансдермальные пластыри ингибирует воспаление при НЯК, чего не наблюдается при болезни Крона [113]. Интересно, что у мышей с колитом, индуцированным тринитробензол-сульфоновой кислотой, получавших анабазин — агонист нХР-α7, — повреждения тканей были менее выраженными, чем у мышей, не получавших его [114]. Никотин также применяли при лечении гангренозной пиодермии и узловатой эритемы, вероятно, ассоциированных с ВЗК, и при лечении злокачественного атрофического папулеза (т. н. болезнь Дегоса) [117], болезни Кимуры [116] и эозинофильного пустулезного фолликулита [118].
Подобно неспецифическому язвенному колиту, рецидивирующий афтозный стоматит (РАС) реже встречается у курильщиков [119]. Известно, что афтозный стоматит при резком прекращении курения также внезапно обостряется, а при возобновлении ослабевает. Заместительная терапия никотином значительно снижает частоту рецидивов РАС — вероятно, никотин можно использовать как лекарственное средство [120]. Хотя опубликованные исследования не говорят о взаимосвязи курения с красным плоским лишаем (КПЛ) слизистой оболочки ротовой полости, известен один случай КПЛ, резистентного к другим методам, который ответил на никотиновую жвачку [121].
Показано, что трансдермальный никотин напрямую снижает воспаление в коже [122]. Никотин и другие агонисты нХР могут оказывать противовоспалительное действие за счет ингибирования пролиферации лимфоцитов, эндоцитоза и фагоцитоза дендритными клетками, а также выработки АФК, супероксида и провоспалительных цитокинов [123]. Вероятно, механизм противовоспалительного действия также обусловлен противовоспалительными цитокинами, IL-10 и TGF-b, глюкокортикоидами и растворимыми рецепторами, нейтрализующими эффекты провоспалительных цитокинов. Никотин стимулирует нХР-α7, которые модулируют воспаление в отсутствие парасимпатической иннервации. Это незаменимый рецептор, необходимый для ингибирования синтеза цитокинов в ходе реализации холинергических противовоспалительных путей [124]. Наоборот, отсутствие нХР-α7 приводит к усилению провоспалительного цитокинового ответа [125].
Заключение
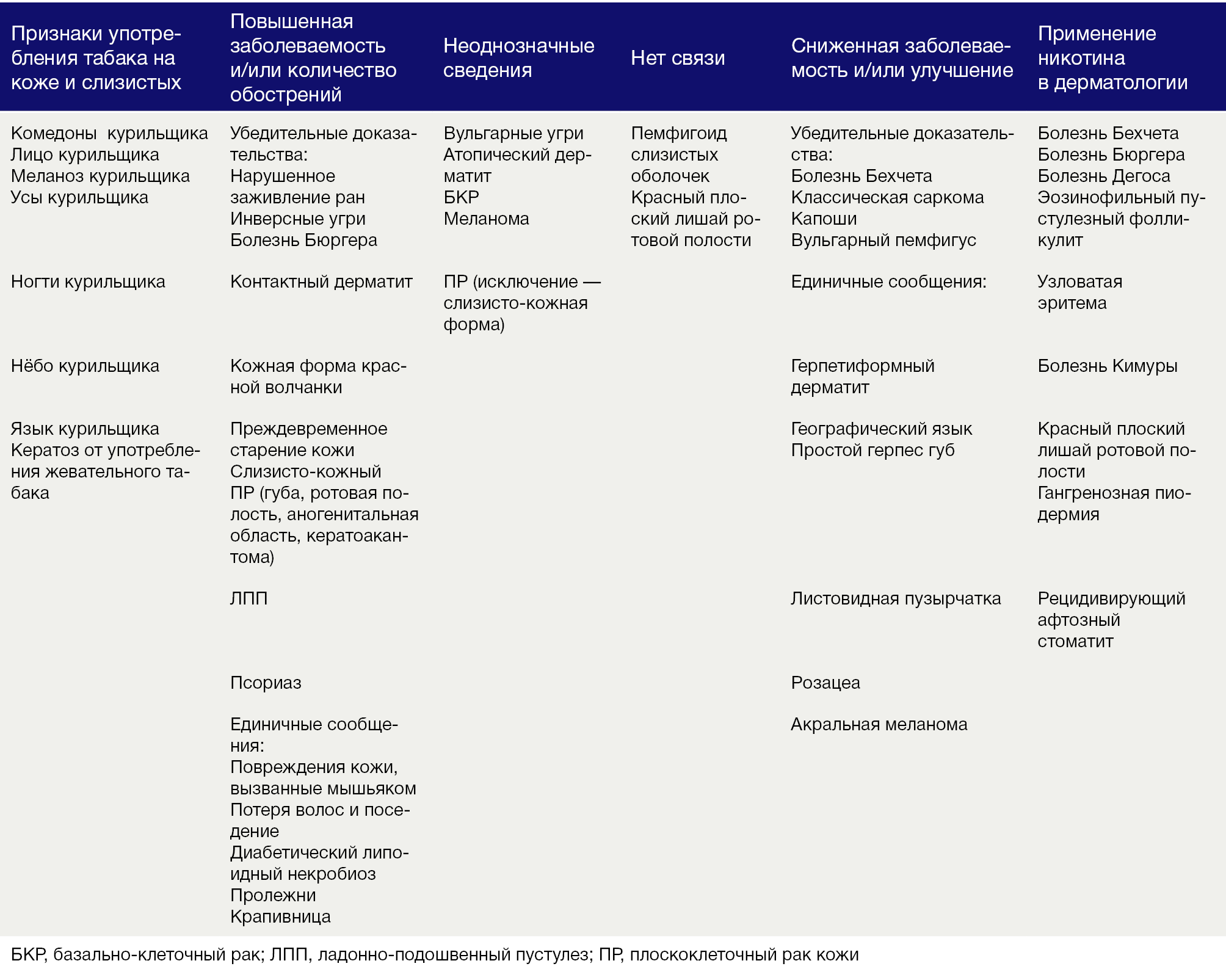
Табак и его компоненты влияют на кожу напрямую и опосредованно. Различные клетки кожи экспрессируют подтипы нХР, активность которых влияет на жизнеспособность клеток и их функции. Изменения в коже обусловлены как геномными, так и негеномными эффектами токсинов табака и агонистов нХР. Эффекты разнообразны: от ускорения процессов старения до мутагенеза. Эпидемиологические исследования установили как положительную, так и отрицательную взаимосвязь табакокурения с различными заболеваниями кожи. Положительная связь с определенными болезнями может благоприятно сказываться на их течении при прекращении курения, тогда как обратная — может требовать специфического лечения агонистами никотина. Важно понимать отличие действия табака и чистого никотина при болезни Бюргера. Частично противовоспалительный эффект никотина обусловлен стимуляцией нХР-α7. Эффекты компонентов табака и чистого никотина приведены в Таблице 1. Необходимы дальнейшие исследования никотинергических веществ в качестве потенциальных терапевтических агентов для некоторых кожных заболеваний.
Таблица 1 | Обобщенные эффекты табака/никотина на кожу
Источники
1 Benowitz NL, Jacob P III. Metabolism of nicotine to cotinine studied by a dual stable isotope method. Clin Pharmacol Ther 1994; 56: 483–493.
2 Kintz P, Henrich A, Cirimele V, Ludes B. Nicotine monitoring in sweat with a sweat patch. J Chromatogr B Biomed Sci Appl 1998; 705: 357–361.
3 Izzotti A, Cartiglia C, Longobardi M, et al. Alterations of gene expression in skin and lung of mice exposed to light and cigarette smoke. FASEB J 2004; 18: 1559–1561.
4 Grando SA, Pittelkow MR, Schallreuter KU. Adrenergic and cholinergic control in the biology of epidermis: physiological and clinical significance. J Invest Dermatol 2006; 126 : 1948–1965.
5 Axell T, Hedin CA. Epidemiologic study of excessive oral melanin pigmentation with special reference to the influence of tobacco habits. Scand J Dent Res 1982; 90: 434–442.
6 Hanioka T, Tanaka K, Ojim a M, Yuuki K. Association of melanin pigmentation in the gingiva of children with parents who smoke. Pediatrics 2005; 116: e186–e190.
7 Wallstrom M, Sand L, Nilsson F, Hirsch JM. The long- term effect of nicotine on the oral mucosa. Addiction 1999; 94: 417–423.
8 Claffey DJ, Stout PR, Ruth JA. 3H-nicotine, 3H- flunitrazepam, and 3H-cocaine incorporation into melanin: a model for the examination of drug-melanin interactions. J Anal Toxicol 2001; 25: 607–611.
9 Domellof L, Andersson M, Tjalve H, et al. Distribution and metabolism of N’-nitrosonornicotine in the miniature pig. Carcinogenesis 1987; 8: 1741–1747.
10 Model D. Smoker’s face: an underrated clinical sign? Br Med J (Clin Res Ed) 1985; 291: 1760–1762.
11 Doshi DN, Hanneman KK, Cooper KD. Smoking and skin aging in identical twins. Arch Dermatol 2007; 143: 1543–1546.
12 Pavlou P, Rallis M, Deliconstantinos G, et al. In-vivo data on the influence of tobacco smoke and UV light on murine skin. Toxicol Ind Health 2009; 25: 231– 239.
13 Gottipati KR, Poulsen H, Starcher B. Passive cigarette smoke exposure inhibits ultraviolet light B-induced skin tumors in SKH-1 hairless mice by blocking the nuclear factor kappa B signalling pathway. Exp Dermatol 2008; 17: 780–787.
14 Chung JH, Lee SH, Youn CS, et al. Cutaneous photodamage in Koreans: influence of sex, sun exposure, smoking, and skin color. Arch Dermatol 2001; 137: 1043–1051.
15 Helfrich YR, Yu L, Ofori A, et al. Effect of smoking on aging of photoprotected skin: evidence gathered using a new photonumeric scale. Arch Dermatol 2007; 143: 397–402.
16 Nicita-Mauro V, Lo Balbo C, Mento A, et al. Smoking, aging and the centenarians. Exp Gerontol 2008; 43: 95– 101.
17 Knuutinen A, Kokkonen N, Risteli J, et al. Smoking affects collagen synthesis and extracellular matrix turnover in human skin. Br J Dermatol 2002; 146: 588–594.
18 Yin L, Morita A, Tsuji T. Alterations of extracellular matrix induced by tobacco smoke extract. Arch Dermatol Res 2000; 292: 188–194.
19 Morita A. Tobacco smoke causes premature skin aging. J Dermatol Sci 2007; 48: 169–175.
20 Just M, Ribera M, Monso E, et al. Effect of smoking on skin elastic fibres: morphometric and immunohistochemical analysis. Br J Dermatol 2007; 156: 85–91.
21 Lahmann C, Bergemann J, Harrison G, Young AR. Matrix metalloproteinase-1 and skin ageing in smokers. Lancet 2001; 357: 935–936.
22 Yin L, Morita A, Tsuji T. Tobacco smoke extract induces age-related changes due to modulation of TGF-beta. Exp Dermatol 2003; 12(Suppl. 2): 51–56.
23 Arredondo J, Nguyen VT, Chernyavsky AI, et al. Functional role of a7 nicotinic receptor in physiological control of cutaneous homeostasis. Life Sci 2003; 72: 2063–2067.
24 Arredondo J, Hall LL, Ndoye A, et al. Central role of fibroblast alpha3 nicotinic acetylcholine receptor in mediating cutaneous effects of nicotine. Lab Invest 2003; 83: 207–225.
25 Odenbro A, Bellocco R, Boffetta P, et al. Tobacco smoking, snuff dipping and the risk of cutaneous squamous cell carcinoma: a nationwide cohort study in Sweden. Br J Cancer 2005; 92: 1326–1328.
26 De Hertog SA, Wensveen CA, Bastiaens MT, et al. Relation between smoking and skin cancer. J Clin Oncol 2001; 19: 231–238.
27 Moore TO, Moore AY, Carrasco D, et al. Human papillomavirus, smoking, and cancer. J Cutan Med Surg 2001; 5: 323–328.
28 Takezaki T, Hirose K, Inoue M, et al. Tobacco, alcohol and dietary factors associated with the risk of oral cancer among Japanese. Jpn J Cancer Res 1996; 87: 555–562.
29 Kabat GC, Chang CJ, Wynder EL. The role of tobacco, alcohol use, and body mass index in oral and pharyngeal cancer. Int J Epidemiol 1994; 23: 1137–1144.
30 Muscat JE, Richie JP Jr, Thompson S, Wynder EL. Gender differences in smoking and risk for oral cancer. Cancer Res 1996; 56: 5192–5197.
31 Smith JB, Randle HW. Giant basal cell carcinoma and cigarette smoking. Cutis 2001; 67 : 73–76.
32 Erbagci Z, Erkilic S. Can smoking and/or occupational UV exposure have any role in the development of the morpheaform basal cell carcinoma? A critical role for peritumoral mast cells Int J Dermatol 2002; 41: 275–278.
33 Shaw HM, Milton GW, McCarthy WH, et al. Effect of smoking on the recurrence of malignant melanoma. Med J Aust 1979; 1: 208–209.
34 Smith JB, Fenske NA. Cutaneous manifestations and consequences of smoking. J Am Acad Dermatol 1996; 34: 717–732; quiz 733–734.
35 Green A, McCredie M, MacKie R, et al. A case-control study of melanomas of the soles and palms (Australia and Scotland). Cancer Causes Control 1999; 10: 21–25.
36 Anderson LA, Lauria C, Romano N, et al. Risk factors for classical Kaposi sarcoma in a population-based case- control study in Sicily. Cancer Epidemiol Biomarkers Prev 2008; 17: 3435–3443.
37 Nawar E, Mbulaiteye SM, Gallant JE, et al. Risk factors for Kaposi’s sarcoma among HHV-8 seropositive homosexual men with AIDS. Int J Cancer 2005; 115: 296–300.
38 Goedert JJ, Scoppio BM, Pfeiffer R, et al. Treatment of classic Kaposi sarcoma with a nicotine dermal patch: a phase II clinical trial. J Eur Acad Dermatol Venereol 2008; 22 : 1101–1109.
39 Sauvaigo S, Bonnet-Duquennoy M, Odin F, et al. DNA repair capacities of cutaneous fibroblasts: effect of sun exposure, age and smoking on response to an acute oxidative stress. Br J Dermatol 2007; 157: 26–32.
40 Curtin GM, Hanausek M, Walaszek Z, et al. Short-term biomarkers of cigarette smoke condensate tumor promoting potential in mouse skin. Toxicol Sci 2006; 89: 66–74.
41 Inaloz HS, Inaloz SS, Deveci E, Eralp A. Teratogenic effects of nicotine on rat skin. Clin Exp Obstet Gynecol 2000; 27: 241–243.
42 Davis R, Rizwani W, Banerjee S, et al. Nicotine promotes tumor growth and metastasis in mouse models of lung cancer. PLoS ONE 2009; 4: e7524.
43 Dasgupta P, Rizwani W, Pillai S, et al. Nicotine induces cell proliferation, invasion and epithelial-mesenchymal transition in a variety of human cancer cell lines. Int J Cancer 2009; 124: 36–45.
44 Song P, Spindel ER. Basic and clinical aspects of non- neuronal acetylcholine: expression of non-neuronal acetylcholine in lung cancer provides a new target for cancer therapy. J Pharmacol Sci 2008; 106: 180–185.
45 Arredondo J, Chernyavsky AI, Jolkovsky DL, et al. Receptor-mediated tobacco toxicity: cooperation of the Ras/Raf-1/MEK1/ERK and JAK-2/STAT-3 pathways downstream of alpha7 nicotinic receptor in oral keratinocytes. FASEB J 2006; 20: 2093–2101.
46 Paleari L, Catassi A, Ciarlo M, et al. Role of alpha7- nicotinic acetylcholine receptor in human non-small cell lung cancer proliferation. Cell Prolif 2008; 41: 936– 959.
47 Paleari L, Sessa F, Catassi A, et al. Inhibition of non- neuronal alpha7-nicotinic receptor reduces tumorigenicity in A549 NSCLC xenografts. Int J Cancer 2009; 125: 199–211.
48 Heeschen C, Jang JJ, Weis M, et al. Nicotine stimulates angiogenesis and promotes tumor growth and atherosclerosis. Nat Med 2001; 7: 833–839.
49 Coppe JP, Boysen M, Sun CH, et al. A role for fibroblasts in mediating the effects of tobacco-induced epithelial cell growth and invasion. Mol Cancer Res 2008; 6: 1085–1098.
50 Rogliani M, Labardi L, Silvi E, et al. Smokers: risks and complications in abdominal dermolipectomy. Aesthetic Plast Surg 2006; 30: 422–424; discussion 425.
51 Manchio JV, Litchfield CR, Sati S, et al. Duration of smoking cessation and its impact on skin flap survival. Plast Reconstr Surg 2009; 124: 1105–1117.
52 Sorensen LT, Karlsmark T, Gottrup F. Abstinence from smoking reduces incisional wound infection: a randomized controlled trial. Ann Surg 2003; 238: 1–5.
53 Sorensen LT, Zillmer R, Agren M, et al. Effect of smoking, abstention, and nicotine patch on epidermal healing and collagenase in skin transudate. Wound Repair Regen 2009; 17: 347–353.
54 Wong LS, Green HM, Feugate JE, et al. Effects of ‘‘second-hand’’ smoke on structure and function of fibroblasts, cells that are critical for tissue repair and remodeling. BMC Cell Biol 2004; 5: 13.
55 Chernyavsky AI, Arredondo J, Wess J, et al. Novel signaling pathways mediating reciprocal control of keratinocyte migration and wound epithelialization through M3 and M4 muscarinic receptors. J Cell Biol 2004; 166: 261–272.
56 Chernyavsky AI, Arredondo J, Marubio LM, Grando SA. Differential regulation of keratinocyte chemokinesis and chemotaxis through distinct nicotinic receptor subtypes. J Cell Sci 2004; 117: 5665–5679.
57 Chernyavsky AI, Arredondo J, Karlsson E, et al. The Ras/Raf-1/MEK1/ERK signaling pathway coupled to integrin expression mediates cholinergic regulation of keratinocyte directional migration. J Biol Chem 2005; 280: 39220–39228.
58 Chernyavsky AI, Arredondo J, Qian J, et al. Coupling of ionic events to protein kinase signaling cascades upon activation of a 7 nicotinic receptor: cooperative regulation of a2-integrin expression and Rho-kinase activity. J Biol Chem 2009; 284: 22140–22148.
59 Sorensen LT, Jorgensen S, Petersen LJ, et al. Acute effects of nicotine and smoking on blood flow, tissue oxygen, and aerobe metabolism of the skin and subcutis. J Surg Res 2009; 152: 224–230.
60 Fulcher SM, Koman LA, Smith BP, et al. The effect of transdermal nicotine on digital perfusion in reformed habitual smokers. J Hand Surg Am 1998; 23: 792– 799.
61 Jacobi J, Jang JJ, Sundram U, et al. Nicotine accelerates angiogenesis and wound healing in genetically diabetic mice. Am J Pathol 2002; 161: 97–104.
62 Morimoto N, Takemoto S, Kawazoe T, Suzuki S. Nicotine at a low concentration promotes wound healing. J Surg Res 2008; 145: 199–204.
63 Sorensen LT, Jorgensen LN, Zillmer R, et al. Transdermal nicotine patch enhances type I collagen synthesis in abstinent smokers. Wound Repair Regen 2006; 14: 247–251.
64 Glick ZR, Saedi N, Ehrlich A. Allergic contact dermatitis from cigarettes. Dermatitis 2009; 20: 6–13.
65 Linneberg A, Nielsen NH, Menne T, et al. Smoking might be a risk factor for contact allergy. J Allergy Clin Immunol 2003; 111: 980–984.
66 Bircher AJ, Howald H, Rufli T. Adverse skin reactions to nicotine in a transdermal therapeutic system. Contact Derm 1991; 25 : 230–236.
67 Goel N, Singh BP, Arora N, Kumar R. Effect of smoking on atopic predisposition and sensitisation to allergens. Indian J Chest Dis Allied Sci 2008; 50: 329–333.
68 Montnemery P, Nihlen U, Lofdahl CG, et al. Prevalence of hand eczema in an adult Swedish population and the relationship to risk occupation and smoking. Acta Derm Venereol 2005; 85: 429–432.
69 Bo K, Thoresen M, Dalgard F. Smokers report more psoriasis, but not atopic dermatitis or hand eczema: results from a Norwegian population survey among adults. Dermatology 2008; 216: 40–45.
70 Huerta C, Rivero E, Rodriguez LA. Incidence and risk factors for psoriasis in the general population. Arch Dermatol 2007; 143: 1559–1565.
71 Zhang X, Wang H, Te-Shao H, et al. Frequent use of tobacco and alcohol in Chinese psoriasis patients. Int J Dermatol 2002; 41: 659–662.
72 Raychaudhuri SP, Gross J. Psoriasis risk factors: role of lifestyle practices. Cutis 2000; 66: 348–352.
73 Akiyama T, Seishima M, Watanabe H, et al. The relationships of onset and exacerbation of pustulosis palmaris et plantaris to smoking and focal infections. J Dermatol 1995; 22: 930–934.
74 Michaelsson G, Gustafsson K, Hagforsen E. The psoriasis variant palmoplantar pustulosis can be improved after cessation of smoking. J Am Acad Dermatol 2006; 54: 737–738.
75 Hagforsen E. The cutaneous non-neuronal cholinergic system and smoking related dermatoses: studies of the psoriasis variant palmoplantar pustulosis. Life Sci 2007; 80: 2227–2234.
76 Boeckler P, Cosnes A, Frances C, et al. Association of cigarette smoking but not alcohol consumption with cutaneous lupus erythematosus. Arch Dermatol 2009; 145: 1012–1016.
77 Gallego H, Crutchfield CE III, Lewis EJ, Gallego HJ. Report of an association between discoid lupus erythematosus and smoking. Cutis 1999; 63: 231–234.
78 Jewell ML, McCauliffe DP. Patients with cutaneous lupus erythematosus who smoke are less responsive to antimalarial treatment. J Am Acad Dermatol 2000; 42: 983–987.
79 Trueb RM. Association between smoking and hair loss: another opportunity for health education against smoking? Dermatology 2003; 206: 189–191.
80 Su LH, Chen TH. Association of androgenetic alopecia with smoking and its prevalence among Asian men: a community-based survey. Arch Dermatol 2007; 143: 1401–1406.
81 D’Agostini F, Balansky R, Pesce C, et al. Induction of alopecia in mice exposed to cigarette smoke. Toxicol Lett 2000; 114: 117–123.
82 Liu CS, Kao SH, Wei YH. Smoking-associated mitochondrial DNA mutations in human hair follicles. Environ Mol Mutagen 1997; 30: 47–55.
83 Schafer T, Nienhaus A, Vieluf D, et al. Epidemiology of acne in the general population: the risk of smoking. Br J Dermatol 2001; 145: 100–104.
84 Firooz A, Sarhangnejad R, Davoudi SM, Nassiri- Kashani M. Acne and smoking: is there a relationship? BMC Dermatol 2005; 5:2.
85 Klaz I, Kochba I, Shohat T, et al. Severe acne vulgaris and tobacco smoking in young men. J Invest Dermatol 2006; 126: 1749–1752.
86 Abram K, Silm H, Maaroos HI, Oona M. Risk factors associated with rosacea. J Eur Acad Dermatol Venereol 2010; 24: 565–571.
87 Revuz JE, Canoui-Poitrine F, Wolkenstein P, et al. Prevalence and factors associated with hidradenitis suppurativa: results from two case-control studies. JAm Acad Dermatol 2008; 59: 596–601.
88 Hana A, Booken D, Henrich C, et al. Functional significance of non-neuronal acetylcholine in skin epithelia. Life Sci 2007; 80: 2214–2220.
89 Sullivan TP, Elgart GW, Kirsner RS. Pemphigus and smoking. Int J Dermatol 2002; 41: 528–530.
90 Valikhani M, Kavusi S, Chams-Davatchi C, et al. Impact of smoking on pemphigus. Int J Dermatol 2008; 47: 567–570.
91 Suman S, Williams EJ, Thomas PW, et al. Is the risk of adult coeliac disease causally related to cigarette exposure? Eur J Gastroenterol Hepatol 2003; 15: 995–1000.
92 Prasad S, Thomas P, Nicholas DS, et al. Adult endomysial antibody-negative coeliac disease and cigarette smoking. Eur J Gastroenterol Hepatol 2001; 13: 667–671.
93 McMillan SA, Johnston SD, Watson RG, et al. Dietary intake, smoking, and transient anti-gliadin antibodies. Scand J Gastroenterol 1998; 33: 499–503.
94 Alexandre M, Brette MD, Pascal F, et al. A prospective study of upper aerodigestive tract manifestations of mucous membrane pemphigoid. Medicine (Baltimore) 2006; 85: 239–252.
95 Sanada H, Sugama J, Kitagawa A, et al. Risk factors in the development of pressure ulcers in an intensive care unit in Pontianak, Indonesia. Int Wound J 2007; 4: 208–215.
96 Delbridge L, Appleberg M, Reeve TS. Factors associated with development of foot lesions in the diabetic. Surgery 1983; 93: 78–82.
97 Mills JL, Taylor LM Jr, Porter JM. Buerger’s disease in the modern era. Am J Surg 1987; 154: 123–129.
98 Wiley DJ, Elashoff D, Masongsong EV, et al. Smoking enhances risk for new external genital warts in men. Int J Environ Res Public Health 2009; 6: 1215–1234.
99 Axell T, Liedholm R. Occurrence of recurrent herpes labialis in an adult Swedish population. Acta Odontol Scand 1990; 48: 119–123.
100 Hirsch JM, Svennerholm B, Vahlne A. Inhibition of herpes simplex virus replication by tobacco extracts. Cancer Res 1984; 44: 1991–1997.
101 Myles ME, Alack C, Manino PM, et al. Nicotine applied by transdermal patch induced HSV-1 reactivation and ocular shedding in latently infected rabbits. J Ocul Pharmacol Ther 2003; 19: 121–133.
102 Kelly WF, Nicholas J, Adams J, Mahmood R. Necrobiosis lipoidica diabeticorum: association with background retinopathy, smoking, and proteinuria. A case controlled study. Diabet Med 1993; 10: 725–728.
103 Lee IW, Ahn SK, Choi EH, Lee SH. Urticarial reaction following the inhalation of nicotine in tobacco smoke. Br J Dermatol 1998; 138: 486–488.
104 Lindberg AL, Sohel N, Rahman M, et al. Impact of smoking and chewing tobacco on arsenic-induced skin lesions. Environ Health Perspect 2010; 118: 533–538.
105 Shulman JD, Carpenter WM. Prevalence and risk factors associated with geographic tongue among US adults. Oral Dis 2006; 12: 381–386.
106 Kawabata H, Kanekura T, Gushi A, et al. Successful treatment of digital ulceration in Buerger’s disease with nicotine chewing gum. Br J Dermatol 1999; 140: 187– 188.
107 Rizvi SW, McGrath H Jr. The therapeutic effect of cigarette smoking on oral/genital aphthosis and other manifestations of Behcet’s disease. Clin Exp Rheumatol 2001; 19: S77–S78.
108 Kaklamani VG, Markomichelakis N, Kaklamanis PG. Could nicotine be beneficial for Behcet’s disease? Clin Rheumatol 2002; 21: 341–342.
109 Kalayciyan A, Orawa H, Fimmel S, et al. Nicotine and biochanin A, but not cigarette smoke, induce anti- inflammatory effects on keratinocytes and endothelial cells in patients with Behcet’s disease. J Invest Dermatol 2007; 127: 81–89.
110 Rubin DT, Hanauer SB. Smoking and inflammatory bowel disease. Eur J Gastroenterol Hepatol 2000; 12: 855–862.
111 Motley RJ, Rhodes J, Ford GA, et al. Time relationships between cessation of smoking and onset of ulcerative colitis. Digestion 1987; 37: 125–127.
112 Wolf JM, Lashner BA. Inflammatory bowel disease: sorting out the treatment options. Cleve Clin J Med 2002; 69: 621–626, 629–631.
113 Thomas GA, Rhodes J, Ingram JR. Mechanisms of disease: nicotine – a review of its actions in the context of gastrointestinal disease. Nat Clin Pract Gastroenterol Hepatol 2005; 2: 536–544.
114 Bai A, Guo Y, Lu N. The effect of the cholinergic anti- inflammatory pathway on experimental colitis. Scand J Immunol 2007; 66: 538–545.
115 Patel GK, Rhodes JR, Evans B, Holt PJ. Successful treatment of pyoderma gangrenosum with topical 0.5% nicotine cream. J Dermatolog Treat 2004; 15: 122–125.
116 Kanekura T, Usuki K, Kanzaki T. Skin disorders with prominent eosinophilic infiltration treated successfully with nicotine. Report of two cases. Dermatology 2004; 208: 153–157.
117 Kanekura T, Uchino Y, Kanzaki T. A case of malignant atrophic papulosis successfully treated with nicotine patches. Br J Dermatol 2003; 149: 660–662.
118 Kanekura T, Mera Y, Mera K, et al. Efficacy of transdermal nicotine patches for eosinophilic pustular folliculitis. Br J Dermatol 2005; 152: 1074–1075.
119 Chattopadhyay A, Chatterjee S. Risk indicators for recurrent aphthous ulcers among adults in the US. Community Dent Oral Epidemiol 2007; 35: 152–159.
120 Hill SC, Stavrakoglou A, Coutts IR. Nicotine replacement therapy as a treatment for complex aphthosis. J Dermatolog Treat 2010; 21: 317–318.
121 Kuwahara RT, Skinner RB, Rosenberg EW. Nicotine gum for oral lichen planus. J Dermatol 2000; 27: 755.
122 Mills CM, Hill SA, Marks R. Transdermal nicotine suppresses cutaneous inflammation. Arch Dermatol 1997; 133 : 823–825.
123 Rehani K, Scott DA, Renaud D, et al. Cotinine-induced convergence of the cholinergic and PI3 kinase-dependent anti-inflammatory pathways in innate immune cells. Biochim Biophys Acta 2008; 1783: 375–382.
124 Wang H, Yu M, Ochani M, et al. Nicotinic acetylcholine receptor alpha7 subunit is an essential regulator of inflammation. Nature 2003; 421: 384–388.
125 Osborne-Hereford AV, Rogers SW, Gahring LC. Neuronal nicotinic alpha7 receptors modulate inflammatory cytokine production in the skin following ultraviolet radiation. J Neuroimmunol 2008; 193: 130–139.
126 Verghese A, Krish G, Howe D, Stonecipher M. The harlequin nail. A marker for smoking cessation. Chest 1990; 97: 236–238.
127 Sedano HO. Tobacco Role in the Etiology of Oral Cancer, Periodontal Disease and Other Oral Lesions. Los Angeles: UCLA’s Periodontics Information Center, 2011.
128 Fisher GJ, Quan T, Purohit T, et al. Collagen fragmentation promotes oxidative stress and elevates matrix metalloproteinase-1 in fibroblasts in aged human skin. Am J Pathol 2009; 174: 101–114.
129 Baradad M, Casanova JM. Atlas de Dermatologia. Lleida, Spain: Facultat de Medicina de Lleida, 2011.
