Лабораторная диагностика гормональных нарушений
Щитовидная железа
Несмотря на то, что эндокринология представляет собой отдельную сложную область медицины, используемые вне зависимости от гормональных систем методы лабораторной диагностики строго подчиняются общим принципам. Прочитав следующие абзацы, вы можете удивиться, насколько все просто.
Большинство гормональных систем функционирует в строгом соответствии друг с другом. Либерины гипоталамуса, воздействуя на переднюю долю гипофиза, приводят к высвобождению гормонов из различных желез. Сами же гормоны по принципу отрицательной обратной связи регулируют высвобождение как тропных гормонов, так и самих либеринов.
В случае щитовидной железы действующими гормонами являются Т3 и Т4. Причем последнего в периферической крови в десять раз больше, а его активность в десять раз меньше, чем у трийодтиронина. В то же время Т3 имеет более короткий период полувыведения, чем Т4. Синтез этих гормонов происходит из тирозина и йода под контролем фермента пероксидазы. Транспорт йода происходит против концентрационного градиента с помощью симпорта с натрием. Т4 в периферических сосудах под действием фермента 5'-дейодазы теряет один йод. Транспорт гормонов в крови осуществляется посредством тироксин-связывающего белка, однако 33 % Т3 и 4 % Т4 связываются с альбумином и преальбумином (Т4 — 18 %, Т3 — 27 %). Концентрация тироксин-связывающего белка часто возрастает при беременности, а также злокачественных новообразованиях. После резекции щитовидной железы тиреоглобулин может больше не обнаруживаться в плазме крови. Норма составляет менее 50 микрограмм в литре крови. Возможно развитие рецидивов и без повышения концентрации тиреоглобулина, тогда в плазме крови обнаруживаются антитела против него.
При первичном гипертиреозе большие концентрации Т3 и Т4 подавляют высвобождение тиреотропина гипофиза, что часто приводят к тиреотоксическим кризам, сопровождающимся гипертермией и тахикардией. Причиной тому может являться Базедова болезнь (65–75 % тиреопатий), при которой в крови обнаруживаются антитела, направленные против рецепторов тиреотропина и стимулирующие их. Если же причина не в самой щитовидной железе, а гипофизе, ситуация противоположная: опухоль гипофиза вырабатывает большое количество тиреотропина, что также приводит к гипертиреозу (вторичному).
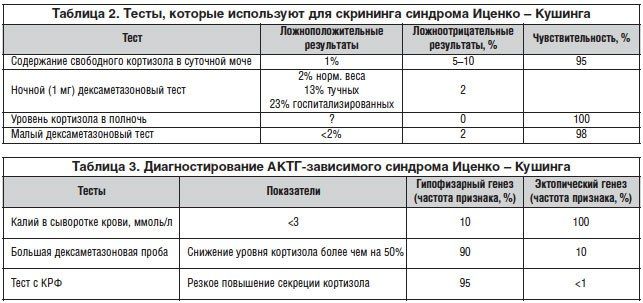
С гипотиреозом ситуация похожая. Причиной первичного гипотиреоза часто является аутоиммунный тиреодит Хашимото (2 % тиреопатий), который приводит (как понятно из названия) к воспалению щитовидной железы. Т-лимфоциты атакуют ткань железы, что приводит к снижению выработки периферических гормонов и регуляторному повышению тиреотропина. Эти антитела направлены против вышеупомянутой пероксидазы (anti-TPO) и тиреоглобулина (Anti-Tg). C помощью иммунологических методов можно определить наличие в крови этих антител. Поскольку антитела к пероксидазе могут быть повышены как при болезни Хашимото, так и при базедовой болезни, этот параметр для контроля заболевания не используют. Для наглядности мы составили для вас таблицу, прикрепленную к посту.
При недостаточности передней доли гипофиза снижена выработка тиреотропина, а значит, и периферических гормонов (вторичный гипотиреоз). Если же проблема в «начальнике начальника» — гипоталамусе, оказывается снижена не только концентрация Т3, Т4 и тиреотропина, но и самого тиролиберина гипоталамуса. Отдельной формой гипотиреоза является синдром низкого Т3 (low-T3-syndrom), который возникает при тяжелых заболеваниях и травмах. Повышение воспалительных цитокинов ингибирует периферическую дейодазу, что приводит к снижению концентрации активной формы гормона (Т3) в плазме крови.
Норма для периферических гормонов:
- fT3 (трийодтиронин свободный): 3,5–8,0 пг/мл (5,4–12,3 пмоль/л)
- fT4 (тироксин свободный): 8–18 пг/мл (10–23 пмоль/л) — чаще используется для оценки текущего состояния пациента. Ложно завышенные значения могут быть следствием терапии гепарином или бета-блокаторами.
При неоднозначных результатах лабораторных анализов тиреотропина и Т3/Т4 для дифференциальной диагностики латентных гипер- и гипотиреоза используют специальный тест с участием тиролиберина. После забора крови на анализ пациенту внутривенно вводят тиролиберин. Через полчаса забор проводят повторно. При вторичном гипотиреозе с поражением гипофиза концентрация тиреотропина не возрастет — в норме же его концентрация должна увеличиться на 2–20 mU/l. При первичном выраженном и латентном гипотиреозах концентрация тиреотропина превысит 20 mU/l. При гипертиреозе из-за большой концентрации Т3 и Т4 в плазме крови концентрация тиреотропина не увеличится, поскольку деятельность гипофиза подавлена таким количеством периферических гормонов по принципу отрицательной обратной связи. При терапии гипертиреоза также должно пройти некоторое время, чтобы концентрация тиреотропина вернулась в норму, поэтому для контроля терапии в первую очередь стоит обращать внимание на концентрацию свободного тироксина fT4. После операции этот гормон может не выявляться вовсе. Его повышение может говорить о недостаточной дозировке заместительных препаратов, периферической резистентности к гормону или же о том, что пациент не выполняет указаний врача. Оптимальным является концентрация гормона в нижней границе нормы.
Концентрация тиреотропина еще до проведения теста может позволить предположить конкретное состояние:
- <0,1 mU/l — гипертиреоз, если Т3/Т4 повышены;
- 0,1–0,2 mU/l — необходимо проведение теста;
- 0,3–3,5 mU/l — эутиреоз;
- 3,5–10 mU/l — необходимо проведение теста, а также скрининг на предмет нарушений обмена йода и йодной недостаточности. Такие концентрации тиреотропина характерны для состояний после операций на щитовидной железе или радиологической диагностики с использованием йода в качестве контрастного вещества. Возможно наличие опухоли гипофиза;
- >10 mU/l — первичный гипотиреоз или опухоль гипофиза.
Уровень тиреотропина используют для контроля терапии тироксином, также он включен в программу скрининга новорожденных. Концентрацию этого гормона определяют с помощью иммунологических методов. При проведении анализов важно учитывать, что следует фокусировать свое внимание на низких и очень низких значениях, чтобы не пропустить возможность наличия у пациента выраженного гипертиреоза.

Глюкокортикоиды
Гормоны надпочечников, в частности, глюкокортикоиды, связаны в крови с особым белком — транскортином. Кортизол ингибирует синтез белков и стимулирует их протеолиз, тормозит расщепление углеводов и глюконеогенез, оказывает иммуносупрессивное и противовоспалительное действие. Зная только лишь эти факты, уже можно догадаться, какими будут симптомы гипер- и гипокортизолизма. При повышенной секреции кортизола у пациента будут наблюдаться увеличение веса, остеопороз, мышечная слабость, повышение давления, склонность к диабету, нарушения менструального цикла, снижение потенции и либидо, а также гирсутизм. При недостаточности этого гормона эффекты противоположные — быстрая потеря веса, гипотонус сосудов, склонность к гипогликемии, депрессии, усталость, гиперпигментация кожи, тошнота и гипокалиемия. Причины возникновения обоих типов гормональных нарушений, как и в случае с гормонами щитовидной железы, могут скрываться как в самих надпочечниках, так и в структурах, их контролирующих.
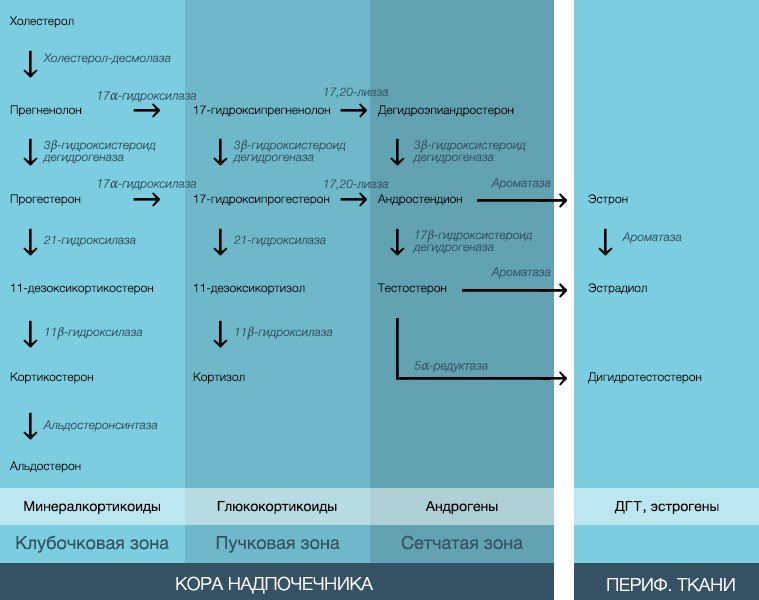
Избыточным образованием кортикостероидов сопровождается синдром Кушинга. Различают ятрогенный и эндогенный синдромы Кушинга. К последнему относят зависимую и независимую от АКТГ формы. Примером АКТГ-независимой формы может служить опухоль надпочечников, вырабатывающая чрезмерное количество кортизола. АКТГ-зависимой формой является болезнь Кушинга, возникающая вследствие аденомы гипофиза, вырабатывающей сам АКТГ. Синтезировать АКТГ способен не только гипофиз, но и эктопические (паранеопластические) клетки, как, например, клетки мелкоклеточных бронхиальных карцином. Также причиной возникновения синдрома Кушинга может являться чрезмерное употребление алкоголя.
Недостаточность кортизола может быть вызвана рядом факторов. К первичным формам, когда проблема заключается в самих надпочечниках, относится болезнь Аддисона. В 70 % случаев надпочечники перестают выполнять свою функцию вследствие аутоиммунных процессов (аутоиммунный адреналит). Но другими причинами могут быть разрушения структуры надпочечников метастазами, возбудителями инфекционных заболеваний (туберкулез, цитомегаловирус при СПИДе), а также последствия аплазии или гипоплазии надпочечников при терапии аминоглютетимидом. Острая надпочечниковая недостаточность может развиваться на фоне синдрома Уотерхауса-Фридериксена (менингококковый сепсис, приводящий к некрозу клеток надпочечников), при кровотечениях у новорожденных и при терапии кумаринами, после оперативного удаления надпочечников.
Вторичные формы гипокортизолизма могут развиваться из-за некорректной работы гипоталамуса и гипофиза, а также при длительной терапии кортикостероидами, подавляющими работу вышеуказанных структур по принципу отрицательной обратной связи.
Итак, чтобы различить все эти формы, клиницисты используют несколько тестов, позволяющих, зная только лишь эту информацию, определить причину гормонального нарушения и назначить дальнейшую диагностику.
Самым быстрым является дексаметазоновый тест. Дексаметазон, являясь синтетическим аналогом кортизола, подавляет синтез АКТГ в гипофизе. В 10–11 часов вечера проводят забор крови у пациента, после чего ему дают дозу дексаметазона, а концентрацию гормонов в крови проверяют лишь следующим утром. Тест проводят, используя дексаметазон в разных количествах. В норме 2 мг дексаметазона утром по принципу отрицательной обратной связи вызывает снижение концентрации кортизола менее 40 микрограммов в литре крови. При гиперкортизолизме супрессии не наблюдается. Правда, следует учитывать, что при ожирении, эндогенной депрессии, а также у больных, находящихся в отделении интенсивной терапии, эта реакция может быть снижена. Таким образом, дозировку в 2 мг используют для исключения подозрений на гиперкортизолизм. При применении дексаметазона в дозировке 8 мг удается выявить причину гиперкортизолизма. Так, при центральной болезни Кушинга (аденоме передней доли гипофиза, вырабатывающей АКТГ) количество кортизола удается снизить более чем на 40 %. При адренальном же синдроме Кушинга или при наличии эктопических клеток, вырабатывающих АКТГ, концентрация кортизола в крови снижается лишь незначительно.
Для дифференциальной диагностики синдрома Кушинга также применяют тест с использованием кортиколиберинов гипоталамуса. До начала теста производят забор крови, после чего проводят инъекцию 100 микрограмм гормона и проверяют уровень АКТГ в крови через 12, 30, 45 и 60 минут. Повышения концентрации АКТГ не происходит, если клетки надпочечников поражены опухолевыми клетками. При гипоталамо-гипофизарном синдроме Кушинга (болезнь Кушинга) концентрация АКТГ и кортизола увеличивается непропорционально сильно.
АКТГ-тест применяют, наоборот, если необходимо исключить наличие у пациента недостаточности надпочечников. Вводя 250 микрограмм аналога этого гормона (синтахтен), удается простимулировать кору надпочечников. Забор крови проводят до начала теста и через 60 минут после него. Увеличение концентрации кортизола в крови более 100 микрограмм на литр плазме крови спустя час является свидетельством нормальной функции коры надпочечников. Незначительное повышение концентрации при изначально низких значениях кортизола является признаком вторичной надпочечниковой недостаточности. Однако при долговременной терапии кортикоидами из-за механизмов отрицательной обратной связи и при первичной надпочечниковой недостаточности подъема концентрации кортизола также не наблюдается. Причиной небольшого увеличения количества кортизола может быть нарушение работы фермента 21-гидроксилазы.
Для диагностики субклинической вторичной надпочечниковой недостаточности используют тест, в основе которого лежит возможность ингибитора 11-бета-гидроксилазы (метопирон) блокировать синтез кортизола и кортикостерона. В норме при снижении концентрации кортизола механизм отрицательной обратной связи ослабевает, что позволяет гипофизу синтезировать большие количества АКТГ. В этом случае количество дезоксикортизола увеличивается, составляя более 70 микрограмм, а АКТГ более 150 нанограмм в литре крови при снижении концентрации кортизола менее 50 микрограммов в литре. Метопирон вводят вечером, а кортизол, 11-дезоксикортизол и АКТГ измеряют в плазме крови на следующий день.
Как было описано выше, кортизол влияет и на обмен углеводов. При введении инсулина и при достижении вследствие этого состояния гипогликемии (менее 40 мг глюкозы в дл крови) здоровые надпочечники начинают вырабатывать кортизол, чтобы противодействовать этому. По понятным причинам тест не находит широкого применения и возможен только стационаре под контролем врача.
Минералокортикоиды
Альдостерон является частью ренин-ангиотензиновой системы. Его главной функцией является стимуляция задержки натрия почками в обмен на выведение их них калия в дистальных почечных канальцах. При снижении концентрации натрия, а вслед за ним и содержания воды в плазме крови в юкстагломерулярном аппарате почек увеличивается синтез ренина. Снижение калия в крови провоцирует развитие метаболического алкалоза, ведь в обмен на положительно заряженный калий в клетки начинают усиленно поступать ионы водорода. Концентрация калия в крови влияет в том числе и на количество высвобождаемого альдостерона, регулируя его концентрацию по принципу отрицательной обратной связи. Сам альдостерон обладает меньшим сродством к протеинам, чем его «сосед по надпочечникам» кортизол. 30–50 % альдостерона находится в плазме крови в свободным виде, остальное его количество связано с альбумином и транскортином. Помимо различных иммунологических методов, для диагностики альдостерона в крови возможно провести анализ на наличие продуктов метаболизма альдостерона в моче: альдостерон-18-глюкуронида (15–20 %) и тетрагидроальдостерона. Альдостерон и кортизол способны активировать одни и те же рецепторы, однако при попадании кортизола в систему капилляров почечных канальцев он тут же инактивируется ферментами, превращаясь в неактивный кортизон. Существуют два изофермента 11-бета-гидроксистероиддегидрогеназы: первый тип активирует кортизон, превращая его в кортизол, вторая же изоформа катализирует обратную реакцию.
Причиной первичного гиперальдостеронизма может являться аденома надпочечников, синтезирующая альдостерон (синдром Кона), а также гиперплазия надпочечников (часто идиопатического генеза, двусторонняя). Из предыдущего абзаца можно догадаться, какими будут типичные симптомы такого заболевания: гипокалиемическая гипертония, патологический коэффициент ренин/альдостерон (много альдостерона, мало ренина), поли- и никтурия, протеинурия, мышечная слабость и головные боли. Удостовериться в диагнозе поможет тест с применением хлорида натрия. При нормальной функции надпочечников при его введении в кровь количество альдостерона снизится. Также следует ожидать увеличения концентрации альдостерона при введении диуретика фуросемида, стимулирующего выведение натрия из организма. При первичной патологии надпочечников концентрация альдостерона не изменяется ни при введении хлорида натрия, ни при введении фуросемида.
Вторичный гиперальдостеронизм часто может сопровождаться увеличением давления, как, например, при феохромоцитоме, при которой адреналин стимулирует высвобождение ренина. Ренин может синтезироваться и опухолями. Также причиной вторичного гиперальдостеронизма могут служить поражения сосудов почек. Прием каптоприла при вторичном гиперальдостеронизме приводит к снижению концентрации альдостерона в крови спустя два часа после его введения. Каптоприл блокирует конвертирующий фермент,поэтому при первичном гиперальдостеронизме после его введения повышения концентрации кортизола не происходит.
Отличием от первичного гиперальдостеронизма от вторичного является вышеупомянутый ренин-альдостероновый коэффициент. В случае вторичного гиперальдостеронизма концентрация обоих этих гормонов увеличивается. При первичном же концентрация ренина скорее снижена.
Клиническая картина гипоальдостеронизма прямо противоположна: гиперкалиемия, гипонатриемия, метаболический ацидоз. Его первичными причинами могут являться надпочечниковая недостаточность, адреногенитальный синдром (дефицит фермента 21-гидроксилазы), а также нарушения секреции ренина (гипоренинемический гипоальдостеронизм при диабетической нефропатии). Для недостаточности альдостерона характерно снижение концентрации альдостерона в крови, и, соответственно, давления, при одновременном повышении ренина. Снижение же обоих гормонов характерно для недостаточности фермента 11-бета-гидроксистероиддегидрогеназы. Из-за нарушения функции второй изоформы этого фермента кортизол не активируется внутри клеток и действует подобно альдостерону. Нелюбимая многими лакрица, которую часто добавляют в мармелад, также обладает свойством ингибировать этот фермент, что при очень сильной передозировке может привести к повышению АД и гипокалиемии.
При резкой смене положения тела из положения лежа в положение стоя (ортостаз) активируется РААС, что у здорового человека приводит к повышению количества альдостерона в крови. У больного гипертонией этот показатель увеличивается куда сильнее. Еще больше выражен этот подъем при стенозе почечных артерий. При болезни Кона и гипоальдостеронизме концентрация альдостерона после такого приема, наоборот, снижается.
Источники:
- Hofmann W., Aufenanger J., Hoffmann G. (ed.). Klinikhandbuch Labordiagnostische Pfade: Einführung-Screening-Stufendiagnostik. – Walter de Gruyter, 2014.
- Renz H. (ed.). Praktische Labordiagnostik: Lehrbuch zur Laboratoriumsmedizin, klinischen Chemie und Hämatologie. – Walter de Gruyter, 2009.
