Генетически модифицированные бактериофаги: обзор достижений последнего десятилетия

Резюме
Бактериофаги были открыты в начале XX века. Вскоре после открытия обнаружился большой потенциал их применения в качестве противомикробных препаратов, который до сих пор не осознается в полной мере. Зарождающаяся область фаговой терапии была скомпрометирована неправильно контролируемыми исследованиями, а после открытия антибиотиков и вовсе отодвинута на второй план. Несмотря на замедление разработок противомикробных препаратов на основе бактериофагов, последние сыграли важную роль в развитии молекулярной биологии. Наблюдаемый в последние годы рост числа мультирезистентных штаммов бактерий способствовал возрождению интереса к противомикробному действию фагов. Благодаря широкому диапазону возможностей генной инженерии эти бактериальные вирусы могут быть модифицированы с целью достижения точного контроля и обнаружения бактерий и, таким образом, послужить новым источником антимикробных средств. Кроме применения в антимикробной терапии, фаги также могут быть использованы как транспортные системы для доставки препаратов, как вакцины или же могут быть использованы для сборки новых материалов. В данном обзоре рассматриваются последние достижения в технологиях создания фагов для всех вышеупомянутых целей, обсуждаются имеющиеся сложности и возможности дальнейших разработок.
Глоссарий
- ЛПС — липополисахарид
- ВПМ — внеклеточный полимерный матрикс
- BRED — рекомбинирование бактериофагов при помощи введения фаговой ДНК путем электропорации
- МЗ — множественность заражения
- дцДНК — двухцепочечная дезоксирибонуклеиновая кислота
- оцДНК — одноцепочечная дезоксирибонуклеиновая кислота
- оцнРНК — одноцепочечная направляющая рибонуклеиновая кислота
- ПЦС — полимеразная циклическая сборка
- TX-TL — бесклеточные системы трансляции-транскрипции
- МПК — минимальная подавляющая концентрация
- IPTG — изопропил-D-тиогалактопиранозид
- AHL — ацил-гомосерин-лактон
- РЭС — ретикулоэндотелиальная система
- РНН — РНК-направляемые нуклеазы
- ФРНН — РНН, упакованные в фагмиду
- ЭДТА — этилендиаминтетраацетат
- ПКНП — поликатионный нанопептид
- КОЕ — колониеобразующие единицы
- GFP — зеленый флуоресцентный белок
- BAP — белок-акцептор биотина
- SWNT — одностенные углеродные нанотрубки
Введение
Бактериофаги (фаги) являются одними из наиболее распространенных биологических частиц на Земле. Они обладают высокой изменчивостью и могут быть адаптированы для широкого диапазона применений. Фаги представляют из себя вирусы, заражающие бактерии; их самовоспроизведение зависит от наличия бактерии-хозяина. Фаги были открыты Фредериком Твортом в 1915 [1] и, независимо от него, Феликсом Д’Эреллем в 1917 [2], и поначалу действительно использовались в качестве противомикробных средств. Несмотря на многообещающие результаты первых испытаний фаговой терапии [3,4], плохой контроль исследований и противоречащие результаты породили в научном сообществе разногласия относительно эффективности и воспроизводимости результатов фаговой терапии в отношении бактериальных инфекций [5‒7]. Открытие пенициллина в 1928 году и последующее наступление эры антибиотиков еще сильней пошатнуло позиции фагов как противомикробных средств [5,6]. В результате в странах Запада изучение фаговой терапии было приостановлено, хотя их применение продолжалось в Восточной Европе и Советском Союзе [8‒10]. Несмотря на значительный успех антибиотиков в улучшении здоровья человечества, все чаще выявляются случаи антибиотикорезистентности, что делает многие антибиотики неэффективными [11‒14]. На данный момент мультирезистентные бактерии представляют собой одну из наиболее распространенных угроз для глобального здоровья [15‒17]. Каждый год только в США более 2 млн человек инфицируются антибиотикорезистентными бактериями, что приводит как минимум к 23000 смертей ежегодно [16]. Нарастающая волна антибиотикорезистентности совместно с низкой скоростью открытия новых антибиотиков [17,18] возродили интерес к фагам как к антибактериальным препаратам [19‒21].
В отличие от большинства антибиотиков, фаги часто обладают высокой специфичностью к определенным видам или штаммам бактерий, и поэтому ожидается, что они будут оказывать меньше побочного действия на комменсальную микрофлору, чем антибиотики [22]. Дополнительными преимуществами фагов являются их самовоспроизводимость и доступность простого, быстрого и дешевого процесса их производства [22]. Фаги использовались не только для лечения и предотвращения бактериальных инфекций у человека [9‒23,25], но также для контроля заболеваемости растений [26‒29], определения патогенов [30‒33] и оценки безопасности пищи [34‒37].
Независимо от их антимикробного потенциала, существует ряд проблем относительно использования фагов в клинической медицине. Специфичность фагов означает, что они будут избирательно поражать только определенные штаммы бактерий; однако тогда один тип фага не сможет инфицировать все штаммы в пределах вида, потому для элиминации широкого спектра бактерий потребуются “коктейли” из нескольких типов фагов. Ввиду высокого разнообразия структуры, жизненного цикла и способа организации генома фагов серьезной проблемой представляется получение одобрения регуляторных органов для применения таких фаговых коктейлей [22,38]. Как и некоторые антибиотики, фаги могут вызывать быстрый массивный лизис бактерий и высвобождение их компонентов (например, липополисахаридов — ЛПС), что может привести к нежелательному иммунному ответу [39,40]. Бактерии часто образуют сообщества в виде биопленки, где они окружены внеклеточным полимерным матриксом (ВПМ), препятствующим проникновению фагов [41]. Кроме того, по мере эволюции бактерии могут также выработать механизмы резистентности к инфицированию фагами [38,42,43], однако преодолеть эти ограничения возможно благодаря генетически модифицированным фагам [44]. Постоянный рост баз данных полного секвенирования геномов фагов [45,46], исследования структуры компонентов фагов [47‒51], а также исследования взаимодействия фагов и бактерий [52‒54] способствуют созданию специфических фагов и их компонентов. В данном обзоре рассматриваются достижения последних десяти лет в области генетической инженерии и применения фагов. Например, авторы обсуждают использование фагов для контроля и определения патогенов, а также их более широкое применение в других областях исследований, включая целенаправленную доставку лекарств и создание материалов.
Техники для создания синтетических фагов
Гомологичная рекомбинация
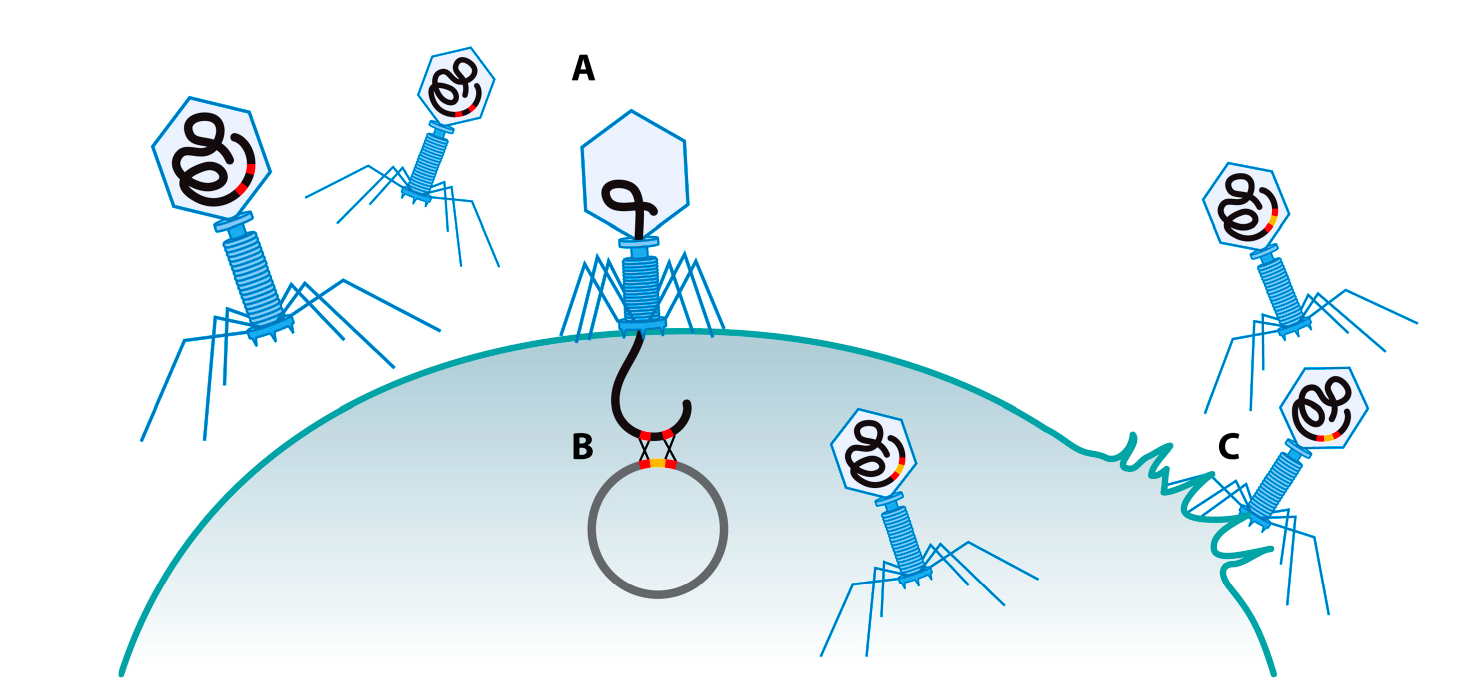
Гомологичная рекомбинация в клетке бактерии-хозяина является наиболее хорошо отработанным и изученным методом создания геномов фагов. Гомологичная рекомбинация может происходить между двумя гомологичными последовательностями ДНК длиной не менее 23 п.н. (пар нуклеотидов) [55,56]. Кроме того, гомологичная рекомбинация является естественным процессом. Она позволяет клеткам частично обменивать попавшую внутрь гетерологичную ДНК с их собственной ДНК при наличии гомологичных участков [57,58]. Этот механизм также может быть использован для внедрения чужеродных генов в геном фагов (Рис. 1). Создание генных вставок, замен или делеций путем гомологичной рекомбинации с фаговой ДНК следует принципам, похожим на те, которые применяются для бактериальных нуклеиновых кислот. Как и во всех методах генной инженерии фагов, описанных ниже, важным моментом для успешного дизайна последовательностей, с помощью которых будут модифицироваться фаги, является секвенирование генома. Ген, который будет введен в геном фага, должен быть фланкирован с двух сторон двумя гомологичными регионами, и сперва этот ген клонируется в репликативных плазмидах. Гомологичные регионы определяют, в какую область генома фага будет внедрен данный ген [59]. Затем бактерия, несущая донорскую плазмиду, инфицируется фагом, который планируется модифицировать. Между геномом фага и плазмиды происходит гомологичная рекомбинация, позволяя гетерологичному гену попасть в геном фага, который затем упаковывается в фаговые частицы [59,60].
Однако лишь небольшая часть получившихся фагов будут рекомбинантными. Обычно частота рекомбинаций составляет от 10-10 до 10-4 [59‒61], хотя, в зависимости от фага и выбранного для манипуляций гена, она может быть и выше. Без эффективных методов скрининга фагов поиск желаемого клона среди получившейся популяции фагов будет как минимум трудоемким. Поэтому для облегчения идентификации мутантных фагов вместе с исследуемым геном обычно вставляют “ген-индикатор” — ген люциферазы или ген флуоресцентного белка [59, 62‒65].
Так как частота рекомбинации при использовании этой методики низкая, очень маловероятно, что при работе сразу с несколькими локусами будут получены клоны, несущие желаемые мутации. Поэтому при необходимости внести несколько мутаций процедуры редактирования генома фага обычно происходят независимо и последовательно, что в итоге превращается в очень долгий процесс.
Рекомбинация бактериофагов электропорацией ДНК
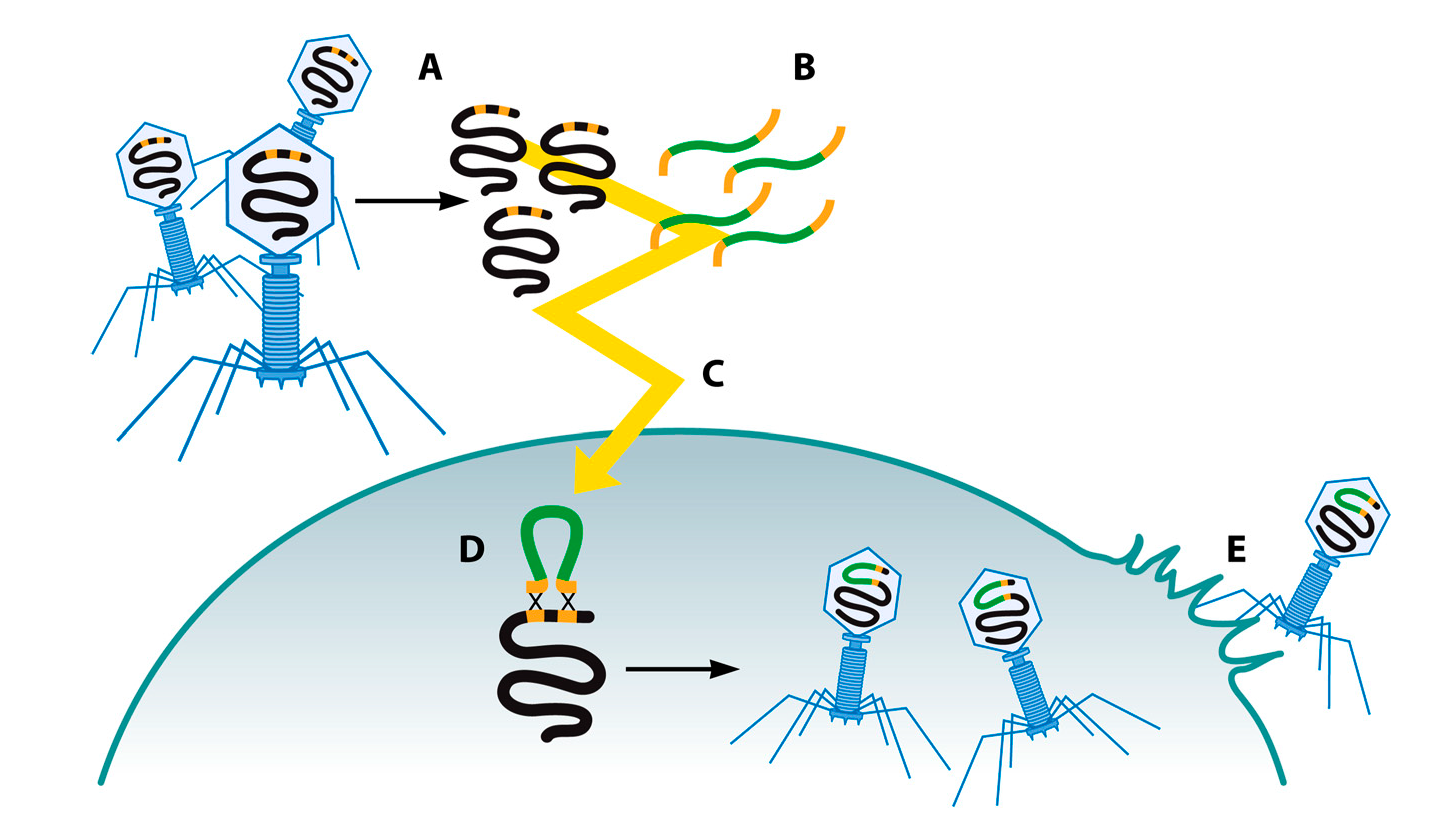
Другим популярным методом редактирования геномов фагов является рекомбинирование бактериофагов при помощи введения фаговой ДНК путем электропорации (bacteriophage recombineering of electroporated DNA — BRED) (Рис. 2) [63,66]. Впервые этот способ был использован Marinelli и соавт. для модификации микобактериофагов [66]. С тех пор спектр модифицируемых таким образом фагов значительно расширился за счет таких фагов, как фаги Escherichia coli и Salmonella enterica [67,68]. BRED может быть использована для удаления, вставки или замены генов, а также для создания точечных мутаций в геноме фагов. Суть методики заключается в совместной электропорации рекомбинируемых субстратов, т. е. ДНК фага и двухцепочечной ДНК (дцДНК) в электрокомпетентные бактериальные клетки, несущие плазмиды с генами белков, обеспечивающих высокий уровень гомологичной рекомбинации, таких как RecE/RecT-подобные белки [63,66]. Субстратная дцДНК включает фрагмент ДНК, который необходимо вставить, и гомологичные участки к локусам выше и ниже участка генома фага, который необходимо изменить [66,69]. После электропорации бактериальные клетки выделяют, смешивают с клетками дикого типа и высевают в чашках Петри. Затем чашки просматриваются на предмет присутствия фаговых колоний, определяемых по лизису бактерий. Отдельные фаговые колонии анализируют на предмет нужной мутации фагового генома при помощи ПЦР [66]. При использовании этой методики удается получить большую долю (10‒15%) успешно модифицированных фагов, что позволяет отбирать необходимых мутантов небольшим числом ПЦР и без необходимости проведения дальнейшего отбора [66]. Эта технология требует наличия высококомпетентных бактериальных клеток.
Рекомбинация in vivo
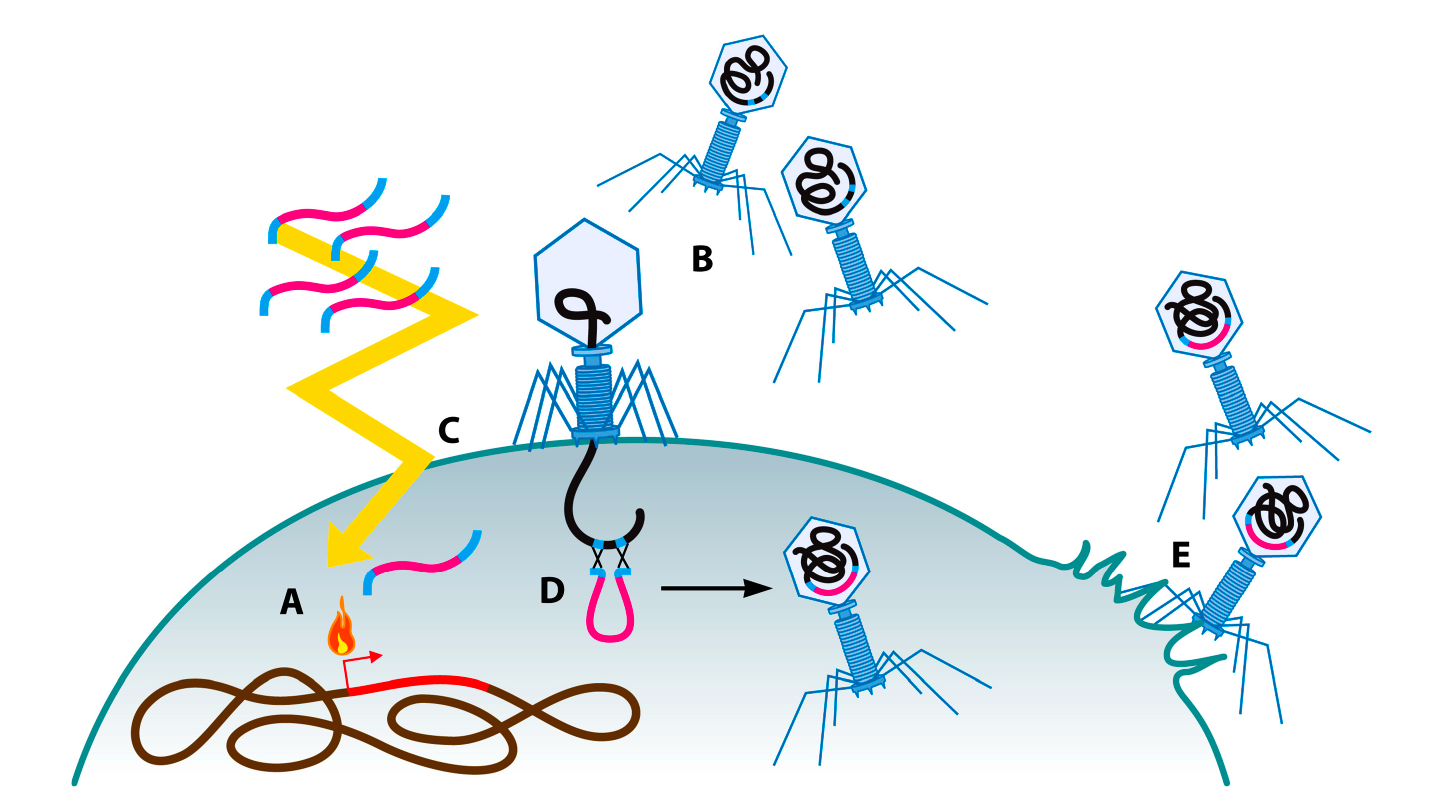
В этом методе одни фаги используются как инструмент для модификации других, менее изученных фагов E. coli (Рис. 3) [70]. Клетки E. coli, несущие дефектный профаг λ и оперон pL, инфицируются фагом, который требуется модифицировать. Множественность заражения (МЗ — количество вирусных/фаговых частиц на клетку (прим. ред.)) обычно составляет от 1 до 3, время абсорбции — 15 минут. Оперон pL, участвующий в общей (гомологической) и сайт-специфической рекомбинации [71], находится под контролем термочувствительного репрессора. При инфицировании фагами и нагревании культуры бактерий до 42°С в середине фазы логарифмического роста происходит стимуляция рекомбинации, контролируемой генами группы Red. В этот момент клетки электропорируются субстратной дцДНК или одноцепочечной ДНК (оцДНК) [69,70]. Затем выделяют фаговый лизат и проверяют его на внедрение субстратной ДНК [70]. Выход рекомбинантных фагов составляет приблизительно 0,5‒2%, что гораздо выше, чем при классической гомологичной рекомбинации, но все еще достаточно мало, поэтому скрининговый поиск мутантных фагов остается непростой задачей [63,66,70]. Эта техника может быть адаптирована к другим фагам и другим видам бактерий путем внедрения системы Red (без фаговой части) или другой системы рекомбинации через плазмиды, в бактерию-хозяина фага, который требуется модифицировать.
Генетическая модификация при помощи системы CRISPR-Cas
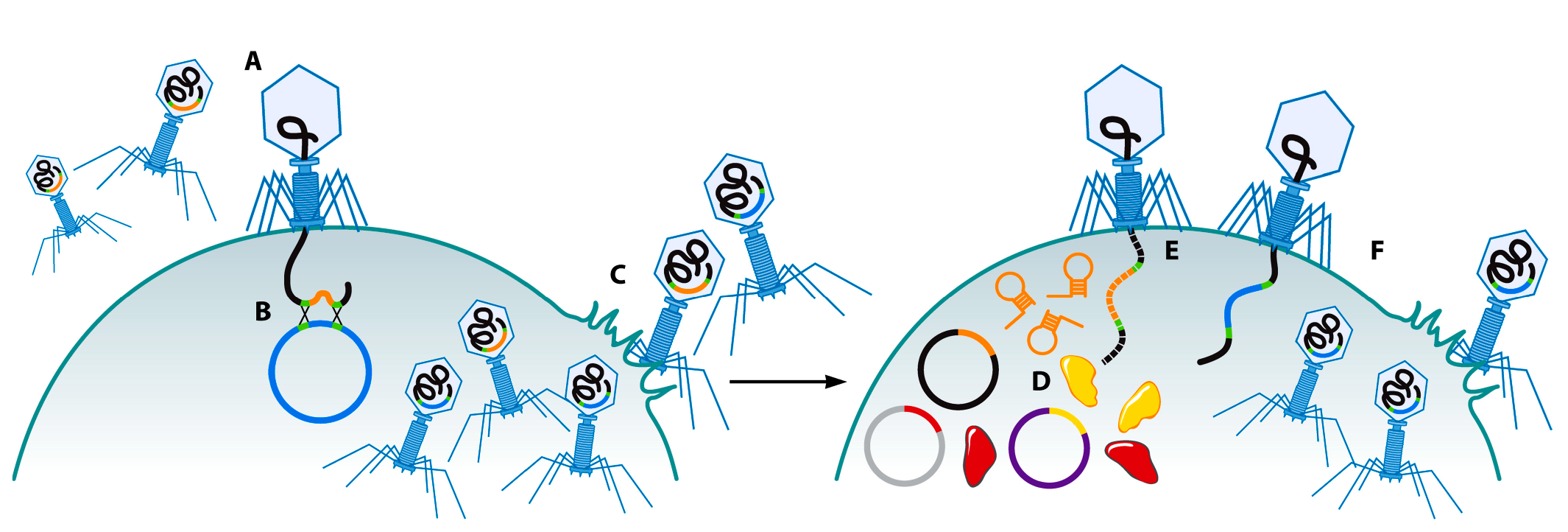
Клетки бактерий и археев имеют “адаптивную” иммунную систему, защищающую микробные клетки от заражения чужеродной ДНК, такой, как ДНК фагов — короткие палиндромные повторы, регулярно расположенные группами (clustered regularly interspaced short palindromic repeats — CRISPR) совместно с генами Cas (CRISPR-associated) [72,73]. Система CRISPR-Cas состоит из двух главных компонентов: белков Cas, которые работают как каталитический центр и выполняют разрезание ДНК, и локуса CRISPR, выполняющего функцию генетической “памяти”, направляющей каталитическую активность против чужеродной ДНК [74]. Обычно локус CRISPR состоит из нескольких несмежных прямых повторяющихся последовательностей, разделенных короткими промежутками различных последовательностей ДНК, называемых спейсерами, полученных от внехромосомных элементов [72,75,76]. На данный момент системы CRISPR-Cas разделяются на 3 главных типа (I, II и III), имеющих различный набор генов Cas и далее разделяющихся на подтипы [77,78]. Механизм работы системы CRISPR-Cas состоит из трех основных процессов, а именно: адаптация CRISPR, биогенез РНК и CRISPR-Cas-интерференция, что подробно описано в обзорах Westra и соавт. [74] и Makarova и соавт. [77]. Недавно Kiro и соавт. описали метод усиления модификации генома фага T7 при помощи системы CRISPR-Cas дикого типа I-E (Рис. 4) [79]. Сперва для удаления ненужного гена фага Т7 (ген 1.7) была использована гомологичная рекомбинация. Фаг T7 предварительно размножался в бактерии-хозяине, несущем плазмиду с гомологичными регионами в области выше и ниже гена 1.7 так, чтобы рекомбинация удаляла этот ген. Полученная популяция фагов состояла из рекомбинантных фагов, лишенных гена 1.7, и не-рекомбинантных фагов дикого типа. Для увеличения доли желаемых рекомбинантных фагов была использована система CRISPR-Cas [79].
Лизат полученной популяции фагов был помещен в чашку петри с бактериями, содержащими 3 плазмиды, кодирующие необходимые для работы системы CRISPR-Cas компоненты: активирующий каскадный комплекс, ферменты Cas3 и нацеленный на ген 1.7 спейсер CRISPR. В результате происходила избирательная элиминация геномов диких фагов, содержащих ген 1.7, а рекомбинантные фаги, у которых целевой ген отсутствовал, выживали. Таким образом ингибировалась репликация первых и увеличивалась — последних. В результате данный метод решал проблему отбора очень малого процента рекомбинантных фагов среди большой смешанной популяции [79]. Аналогичным образом система CRISPR-Cas Streptococcus thermophilus типа II-A была использована для отбора рекомбинантных стрептококковых фагов 2972, имевших точечные мутации, малые и большие делеции в ДНК и замены генов [80]. Остается выяснить, насколько данная технология будет применима для других фагов и бактерий.
Создание/пересборка геномов фагов in vitro
До того, как геном фагов будет введен в бактериальную клетку-хозяина, его можно редактировать или производить другие манипуляции. Например, в 2005 году Chan и соавт. перестроили геном фага Т7, убирая перекрытия между сегментами генома в процессе, известном как пересборка (Рис. 5) [81]. 73 сегмента были сгруппированы в 6 секций. По краям каждой секции были добавлены сайты рестрикции так, что ДНК могла быть изменена в пределах одной секции без затрагивания функциональности других. Затем из таких секций in vitro путем молекулярного клонирования были собраны измененные геномы. Таким способом Chan и соавт. собрали три химерных генома фага Т7, а затем, после переноса этих геномов в бактериальные клетки, воспроизвели жизнеспособных модифицированных фагов. Однако многие из них образовывали гораздо меньшие лизаты на колониях бактерий, чем фаги дикого типа, подтверждая неблагоприятные последствия произведенного вмешательства [81]. С этим подходом связаны следующие проблемы: сложность работы с большими фрагментами ДНК in vitro и потребность в трансформации бактерий с измененным геномом с целью выделения жизнеспособных фагов, что может оказаться малоэффективным процессом, особенно у малоизученных бактерий.
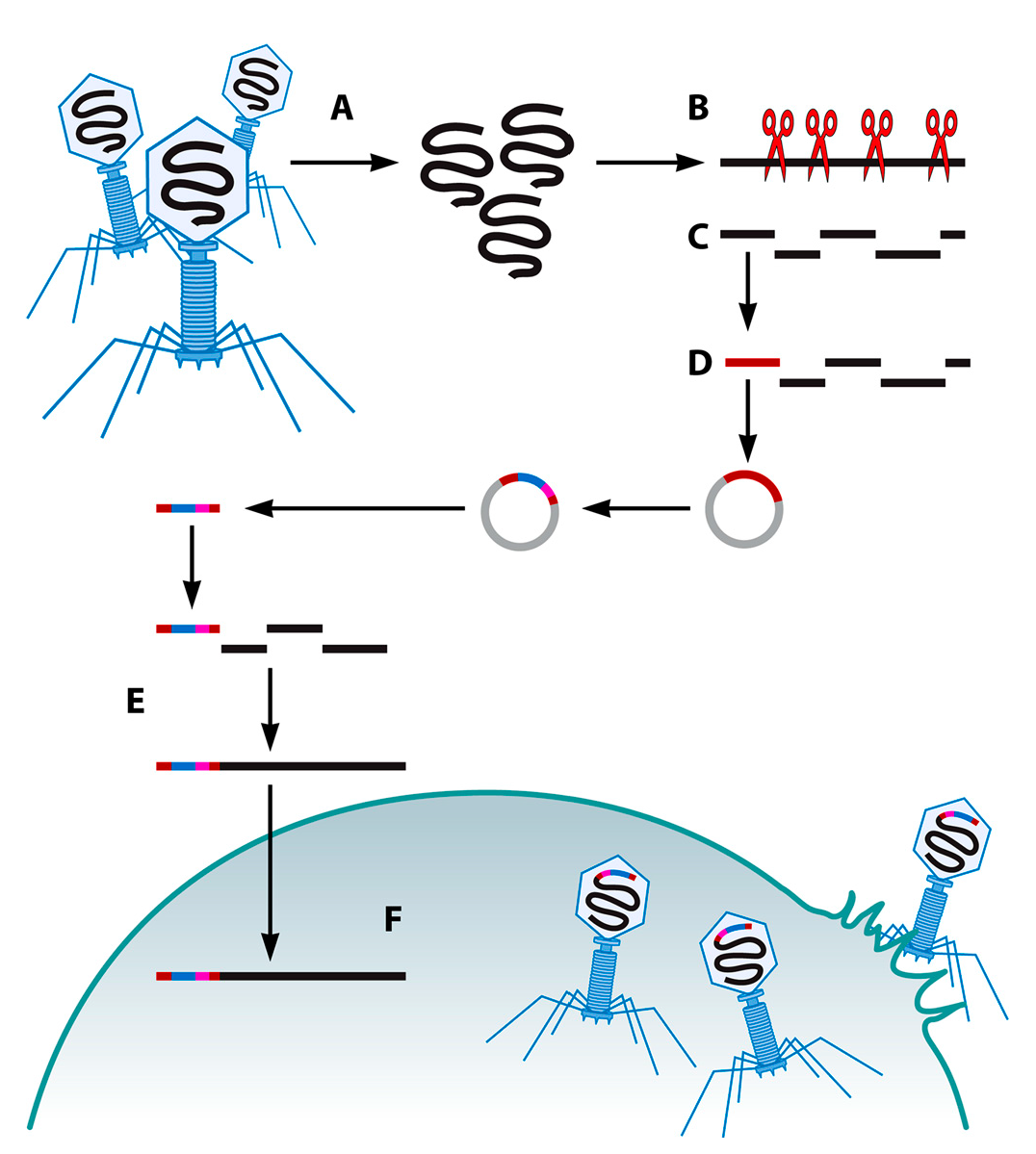
Полногеномный синтез и сборка из синтетических олигонуклеотидов
Полноценный геном фагов может быть собран из синтетических олигонуклеотидов in vitro. Таким способом был собран весь геном фага Х174 (5386 п.н.) (Рис. 6) [82,83]. Синтетические олигонуклеотиды были очищены методом выделения из агарозного геля, фосфорилированы, подвергнуты отжигу и собраны при помощи полимеразной циклической сборки (ПЦС). Цельные геномы были амплифицированы в ходе ПЦР, расщеплены рестриктазой, очищены в геле и зациклены путем лигации (т. к. фаг Х174 имеет замкнутый кольцевой геном). Затем собранные геномы Х174 были введены в E. coli путем электропорации, и засеянные в чашку Петри колонии проверялись на наличие фаговых лизатов. Синтетический геном фага показал более низкую вирулентность, чем ДНК исходного фага. Эта разница была связана с мутациями, генерируемыми полимеразой, использованной в данной методике (1 на 500 п.н.)[83]. Тем не менее, авторам удалось выделить жизнеспособных фагов. Данный подход ограничен размерами генома фагов ввиду трудностей при работе с большими молекулами ДНК in vitro и потенциальными мутациями, возникающими в ходе ПЦР. Однако, синтез и сборка ДНК in vitro позволяет более произвольно вводить генетические мутации в геном фагов, чем методы с использованием рекомбинации [83].
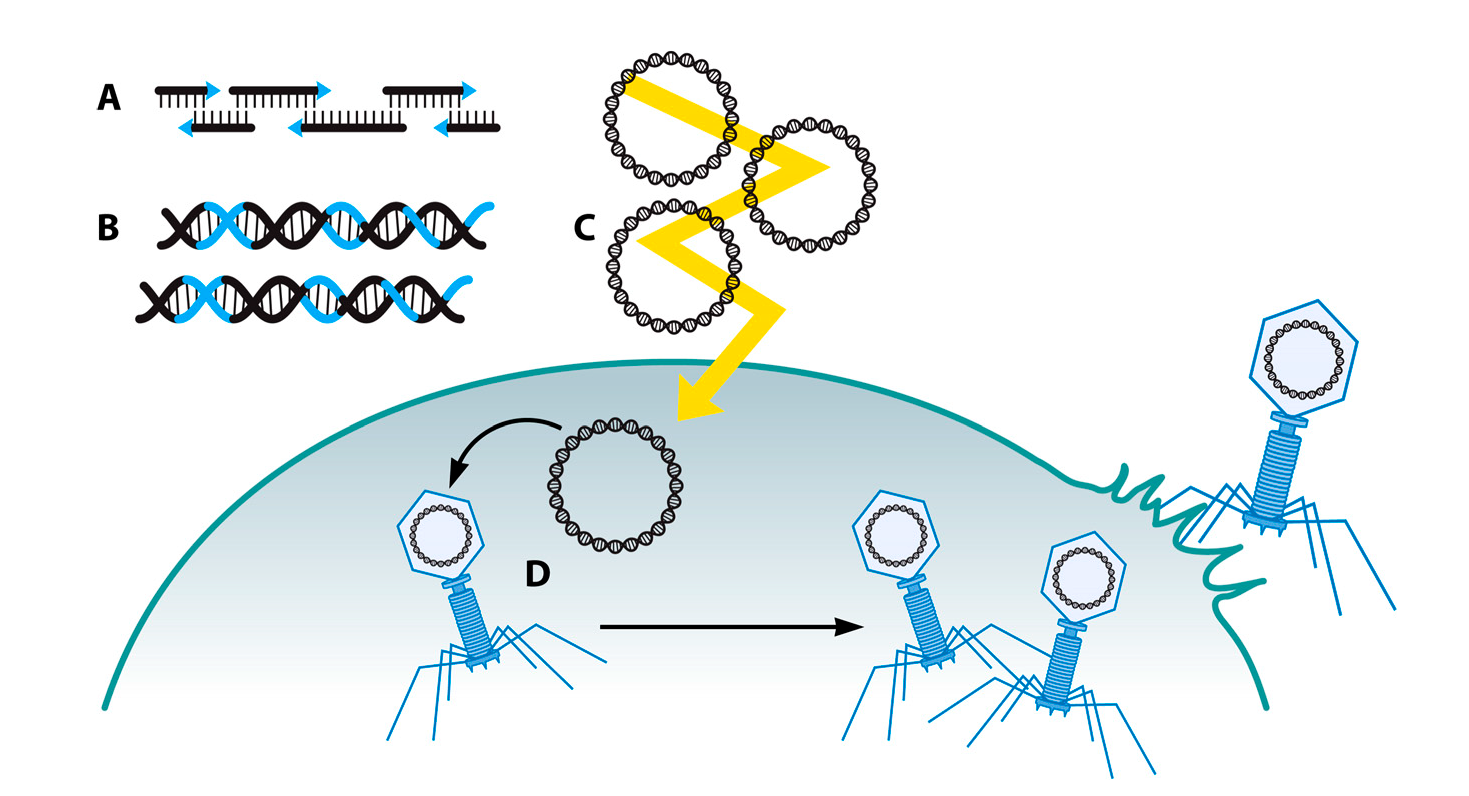
Сборка фаговых геномов с использованием дрожжей
Размножение фагов внутри бактериальных клеток вызывает токсическое действие на бактерии, что ограничивает эффективность таких методов генетической модификации фагов, как гомологичная рекомбинация, BRED и рекомбинация in vivo. Данная проблема может быть решена путем использования в качестве промежуточного хозяина дрожжевых грибков вида Saccharomyces cerevisiae. Гомологичная рекомбинация при работе с Saccharomyces cerevisiae проходит особенно эффективно, а геномы фагов не оказывают токсического действия на дрожжевые грибки и могут подвергаться манипуляциям со стабильным результатом (Рис. 7) [84]. При использовании этой методики геном фага из S. cerevisiae переносится в бактерию при помощи так называемого шаттл-вектора. Для рекомбинации шаттл-вектора и фагового генома (с целью их соединения) необходимо, чтобы они имели гомологичные выступающие концы. То есть, в дрожжевой клетке происходит сборка, модификация и репликация геномов фага, затем они выделяются и доставляются внутрь бактериальной клетки для образования функциональных фаговых частиц [84]. Такая техника использовалась для выделения и генной модификации колифагов Т3 (38,208 п.н.), Т7 (39,937 п.н.) [84,85] и фага клебсиеллы К11 (41,181 п.н.) [85]. Более того, с помощью этой же методики ученые сохранили геном собранного с нуля фага X174 (6,302 п.н.) Эта стратегия подразумевает экстракцию генома фага из дрожжей и внедрение его в бактерию, что делает эффективность бактериальной трансформации ограничивающим фактором эффективности всего процесса.
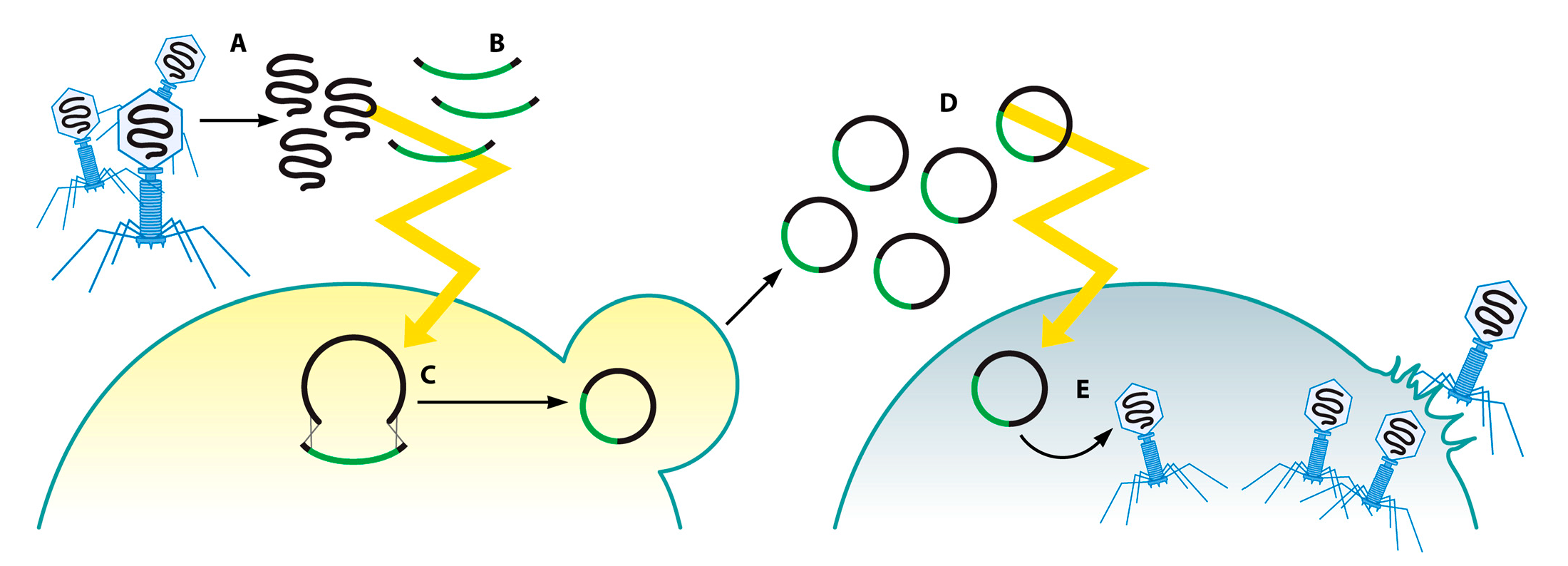
Бесклеточные системы трансляции-транскрипции
Одним из основных преимуществ использования генных модификаций in vitro или при помощи дрожжевых культур является то, что преобразования геномов фага могут осуществляться без повреждения клеток-носителей. При создании функционирующих фрагментов фагов из геномов, модифицированных in vitro или в дрожжевых культурах, ученые чаще всего полагаются на трансформацию как на способ возврата геномной ДНК обратно в бактериальную клетку-хозяина, где фаги могли бы “запуститься” (то есть из ДНК начали бы производиться жизнеспособные фаговые частицы). Однако, данный процесс требует высоких темпов трансформации, особенно в случаях, когда геном фага достаточно велик. В то время, как для одних бактерий были разработаны протоколы высокоэффективной трансформации (E.coli, Pseudomonas aeruginosa), другие виды бактерий поддаются трансформации труднее, что ограничивает пропускную способность и эффективность методов генной инженерии фагов при помощи дрожжей и систем in vitro.
Возможное решение этой проблемы предлагают бесклеточные системы транскрипции-трансляции (TX-TL). Такие системы, к примеру, использовались для репликации, синтеза и сборки генома фага Т7 (Рис. 8) [87]. В данном случае геномная ДНК фага длиной 1 нм, комбинированная с бесклеточной TX-TL системой, полученной из E. Coli BL 21 Rosetta2, за несколько часов позволила получить в инкубации реакционную смесь из инфекционных частиц в концентрации приблизительно 0,1‒1,0 млрд фаговых частиц/мл. В будущем крайне важно протестировать данный метод на большем диапазоне фаговых геномов, чтобы определить широту его применимости.
Модификация фагов для контроля патогенов
Антимикробные препараты на основе природных фагов
Противомикробный потенциал вирулентных фагов в отношении мультирезистентных бактерий изучался как in vivo [92‒98], так и in vitro [88‒91]. Натуральные фаги использовались в терапевтической практике с 1919 года, когда Д’Эрелль с помощью фагов успешно лечил детей с дизентерией тяжелого течения. Позже были проведены исследования применения фагов в клинической практике, в частности, для лечения хирургических инфекций и гнойных поражений [3,99,100]. Даже после открытия антибиотиков фаговая терапия продолжала применяться на территории бывшего Советского Союза и в странах Восточной Европы [7,9]. Несмотря на данные многочисленных исследований о потенциале и безопасности фаговой терапии у пациентов с бактериальными инфекциями [23,92,94,101‒104], широкое использование фагов в западной медицине на данный момент все еще ожидает одобрения регуляторных органов. Кроме этого, на пути внедрения фаговой терапии в широкое применение стоят такие проблемы, как бактериальная устойчивость к фагам, узкий спектр активности отдельных типов фагов и обеспокоенность иммуногенностью фаговой терапии [44].
В ходе эволюции бактерии могут быстро приобретать устойчивость к фагам. Показано, что при введении фагов в культуру чувствительных бактерий in vitro, резистентные формы могут спонтанно появляться уже через несколько часов, так же, как и при обработке культуры бактерий антибиотиками [91,107‒109]. Бактериальная клетка может избежать инфицирования фагами несколькими способами.
- Блокирование адсорбции препятствует прикреплению фага к рецепторам на мембране бактерии. Этот процесс обеспечивается утратой или изменением рецепторов, физическими барьерами, такими как ВПМ, закрывающими рецепторы бактерий, или синтезом молекул, которые, присоединяясь к рецепторам, делают их недоступными для фагов.
- Бактерии могут препятствовать проникновению фаговой ДНК с помощью систем исключения суперинфекции.
- Бактерии способны расщеплять нуклеиновые кислоты фагов с помощью систем CRISPR-Cas, защищающих бактериальные клетки от вторжения чужеродной ДНК.
- Абортивная инфекция может приводить к преждевременной гибели клетки и прекращению дальнейшего инфекционного процесса [38,42].
В свою очередь, фаги способны противостоять данным механизмам устойчивости, в основном за счет пластичности их генома и высокой скорости репликации [43]. Своим многообразием фаги обязаны точечным мутациям, перегруппировке генома и обмену генетическим материалом с другими фаговыми частицами или бактериями [43]. Возможности генной инженерии, мутагенеза и скрининга новых фагов с высокой пропускной способностью могут проложить путь для быстрого создания модифицированных фагов, способных преодолеть механизмы защиты бактерий.
Медицинские продукты на основе фагов постепенно получают все большее признание. Клиническое исследование PhagoBurn, финансируемое Европейской Комиссией, призвано оценить эффективность местного применения специализированного коктейля из фагов для терапии инфекций, вызванных E. coli и P. aeruginosa у пациентов с ожогами [110]. PhagoBurn — первое исследование такого рода и, хотя пока что в нем используются натуральные фаги, не за горами тот день, когда в таких исследованиях будут изучаться генно-инженерные фаги. Хотя малое количество пациентов (всего 9) не позволило адекватно оценить терапевтическую эффективность “фагового коктейля”, при его применении не было выявлено никаких побочных эффектов или осложнений (на момент перевода исследование PhagoBurn завершено, однако результаты его еще не опубликованы (прим. ред.)) [110]. Также не было обнаружено побочных эффектов приема фага E.coli T4 в исследовании по оценке безопасности фаговой терапии, описанном Bruttin и Brüssow, в котором 15 здоровых волонтеров принимали фаг перорально [103]. В этих клинических исследованиях использовались или используются исключительно природные фаги, но смягчение нормативных барьеров может в будущем способствовать разработке и клиническим испытаниям генно-модифицированных фагов.
Также ряд исследований был посвящен изучению применения природных фагов в агрокультуре [28,29], безопасности пищевых продуктов [34,36,37] и ветеринарии [96,111,112]. Например, к применению в работе с пищевыми продуктами были одобрены несколько препаратов на основе природных фагов. Такие препараты, как ListShield, EcoShield и SalmoFresh производства компании Intralytix, созданы для контроля соответствующих патогенных бактерий — Listeria monocytogenes, E. coli O157: H7 и S. enterica в продуктах питания или на объектах пищевой промышленности. Salmonelex и Listex P100 от компании Micreos снижают инфицированность Salmonella и L. monocytogenes на производстве пищевых продуктов. AgriPhage от OmniLytics регулирует присутствие Xanthomonas campestris и Pseudomonas syringae на томатах и перцах.
Модификация фагов для повышения их антибактериальной активности
Кроме их прямой антимикробной активности, фаги могут быть использованы в качестве дополнения к другим видам антимикробной терапии. Например, можно модифицировать фаги для увеличения бактерицидной активности антибиотиков [113]. Так, Lu и Collins модифицировали умеренный фаг M13mp18 для сверхэкспрессии lexA3, репрессора системы репарации ДНК SOS, чтобы усилить бактерицидное действие антибиотиков в отношении E. coli [113]. Введение фага, продуцирующего lexA3, совместно с фторхинолоновым антибиотиком (офлоксацином) in vitro значительно повышало бактерицидное действие против EMG2 E. coli дикого типа — на 2,7 (по сравнению с офлоксацином вместе с природным фагом) и 4,5 порядков (по сравнению с только офлоксацином). Созданный фаг также увеличивал бактерицидную активность других антибиотиков, таких как гентамицин и ампициллин. Усиление бактерицидной активности наблюдалось уже через 6 часов после введения фага. Модифицированный фаг также усиливал бактерицидное действие антибиотиков, к которым бактерии уже приобрели резистентность и уничтожал персистирующие патогены и биопленки, что позволило снизить шанс появления антибиотикорезистентных мутантов. Данная стратегия также была эффективной у мышей, инфицированных E. coli. При использовании модифицированного фага с офлоксацином выживаемость составила 80% против 50% при лечении немодифицированным фагом с офлоксацином и 20% для лечения только офлоксацином [113].
В другой методике снижения устойчивости бактерий к антибиотикам Edgar и соавт. спроектировали умеренные фаги для доставки в бактерию генов, кодирующих чувствительность к антибиотикам [114]. Доминантные гены rpsL и gyrA, придающие чувствительность к стрептомицину (аминогликозиду) и налидиксовой кислоте (хинолону), были встроены в фаг путем гомологичной рекомбинации. Для начала авторы создавали устойчивые штаммы E. coli K-12, подвергая их воздействию указанных антибиотиков. Затем им удалось осуществить лизогению полученных антибиотикорезистентных штаммов с помощью модифицированных фагов (содержащих rpsL или gyrA), после чего оценивалась минимальная подавляющая концентрация антибиотиков (МПК). После лизогении у бактерий восстанавливалась восприимчивость к обоим антибиотикам: МПК уменьшалась в 8 раз для стрептомицина и в 2 раза для налидиксовой кислоты [114].
Помимо достижения целей по повышению активности антибиотиков, фаги можно модифицировать как самостоятельные противомикробные агенты, которые были бы более эффективны для борьбы с бактериальными инфекциями, чем соответствующие природные фаги. Существуют бактерии, являющиеся облигатными внутриклеточными паразитами, которые недоступны для фагов, находящихся во внеклеточном пространстве, например, Chlamydia trachomatis, наиболее распространенный возбудитель заболеваний, передающихся половым путем [115,116]. Для подавления роста C. trachomatis была произведена модификация фага М13, способного путем эндоцитоза попадать в эукариотические клетки. Суть модификации заключалась в добавлении генов двух функциональных пептидов: интегрин-связывающего пептида (RGD), который экспессировался на главном белке капсида p8-, и пептида, полученного из белка C. trachomatis (PmpD), после модификации экспрессирующегося на минорном белке капсида p3 [115]. RGD индуцировал интегрин-опосредованный эндоцитоз эукариотической клеткой. PmpD, в свою очередь, прерывал внедрение и размножение C. trachomatis. Модифицированный фаг либо использовался для предварительной обработки клеток линии HeLa и первичной культуры эндоцервикальных клеток перед инфекцией, либо добавлялся одновременно с бактериями. Результаты флуоресцентной микроскопии и измерения количества образованных включений показали значительное подавление C. trachomatis в обеих клеточных линиях, хотя эффективность фага была более выраженной при введении в первичные эндоцервикальные клетки одновременно с бактерией [115].
Westwater и соавт. описали использование модифицированных фагов в качестве систем доставки летальных генов [117]. Летальные гены gef и chpBK были выделены из E. coli XL1-Blue MRF и клонированы под контролем LacI/IPTG-управляемого промотора (IPTG — изопропил-D-тиогалактопиранозид) в вектор, содержащий интерцистронный район фага f1. Затем клетки E. coli, несущие эту фагмиду, были инфицированы M13-хелперным фагом R408, что позволило иметь преимущество фагмидной ДНК над ДНК хелперного фага: 95% полученных лизатов состояло из фагмидных частиц, содержащих летальные гены.
Данные лизаты затем использовались для инфицирования клеток E. coli, инкубированных в присутствии IPTG. После инкубации в течение ночи количество жизнеспособных клеток снизилось в 948 раз в присутствии Gef-экспрессирующей фагмиды и в 1579 раз с помощью ChpBK-экспрессирующей фагмиды [117]. Фагмиды, доставляющие летальные гены, также снизили титры бактерий у мышей более чем на 90% через 5 часов после внутрибрюшинной инъекции [117].
Биопленки, которые обычно связаны с персистирующей и хронической бактериальной инфекцией, представляют собой структурированные микробные сообщества со сниженной метаболической активностью, особенно во внутренних слоях. Восприимчивость биопленок к антимикробным агентам, включая фаги и антибиотики, может быть даже меньше, чем у планктонных бактерий [118]. Этот эффект часто приписывают либо веществу биопленок, которое может ограничивать диффузию молекул и частиц, либо замедленному метаболизму бактерий [41,119,120]. Чтобы решить проблему пониженной эффективности фагов против биопленок, Лу и Коллинз модифицировали фаг Т7 так, чтобы тот экспрессировал фермент дисперсин B (DspB), разрушающий биопленки [121]. В частности, ген dspB из Actinobacillus actinomycetemcomitans внедрили после гена капсида T7select 415-1 10B под контролем промотора T7 10. Этот модифицированный фаг был эффективен против биопленок TG1 E. coli, уменьшая количество клеток биопленки на 4,5 порядка спустя 24 часа после добавления, что на 2 порядка больше, чем у фага дикого типа [121]. В будущем в этой технологии могут быть использованы другие ферменты, воздействующие на гетерогенное внеклеточное вещество биопленок с целью достижения более эффективного разрушения биопленок, поскольку те могут состоять из множества различных бактерий, производящих широкий спектр компонентов матрикса.
Фаг T7 также был модифицирован для кодирования фермента, который препятствует такому феномену, как quorum sensing [122], способу коммуникации бактерий, участвующих в образовании биопленки [123, 124]. Этот модифицированный фаг (T7aiiA) был создан путем клонирования гена ацил-гомосерина лактоназы (AHL-лактоназы) aiiA от Bacillus anthracis в фаговый вектор T7select 415-1 [121,122]. Этот кворумподавляющий фермент инактивирует молекулу ацил-гомосерин-лактона (AHL), ответственную за quorum sensing [125]. Чтобы оценить влияние кворумподавляющего фага T7aiiA на образование биопленок, из смеси E. coli и P. aeruginosa была сформирована биопленка при добавлении модифицированного фага и фага дикого типа в течение 4 и 8 часов [122]. Фаг T7aiiA через 4 и 8 часов уменьшил биомассу бактерий на 74,9% и 65,9% соответственно, тогда как натуральный фаг T7 вызвал снижение лишь на 23,8% и 31,7% по сравнению с контролем (без фага) [122].
Создание фагов со смещенным или расширенным тропизмом
Каждый тип фагов способен инфицировать весьма ограниченный диапазон штаммов бактерий конкретного вида. С одной стороны, такая специфичность позволяет рассматривать фаги как весьма точные антимикробные агенты, но в то же время это является одним из основных препятствий в фаговой терапии, так как перед началом лечения необходимо знать, активен ли конкретный тип фагов в отношении тех или иных бактерий. Наиболее распространенный подход, направленный на решение проблемы узкоспециализированного таргетного воздействия фагов, заключается в комбинировании фагов с разным тропизмом, благодаря чему такое комбинированное терапевтическое средство может быть использовано против более широкого спектра бактериальных инфекций, чем мог бы охватить какой-либо тип фагов в отдельности. Несмотря на перспективность данного подхода [94,126‒128], воздействовать на все бактериальные штаммы в пределах вида все же весьма затруднительно, а большое разнообразие фагов в рамках одного комбинированного препарата может вести к непреднамеренному поражению бактерий, находящихся вне желаемого диапазона. Данная проблема касается как естественных фагов, так и генно-инженерных фагов нынешнего поколения. Подбор фаговых комбинаций может также потребовать оптимизации соотношения количества фагов в одном препарате с целью повышения его эффективности [129,130], что может быть решено на этапе доклинических испытаний и специальных экспериментов. Создание комбинаций из большого числа разнообразных фагов сопровождается сложностями в производстве, изготовлении и технической организации, потому в качестве альтернативы рассматривается подбор более единообразных групп фагов на основе общего ядерного скелета и диапазона антибактериального действия, который может несколько смещаться и/или расширяться.
Чтобы доказать возможность изменения или расширения тропизма фагов, некоторые исследователи обратили внимание на то, что тропизм некоторых фагов связан со структурой их хвостового отростка. Например, Yoichi и соавт. [131] генетически модифицировали фаг T2, заменив гены длинного «хвоста» (gp37 и gp38) фага на гены, полученные от фагов PP01, специфичных в отношении E. coli O157:H7. Замена генов была произведена путем гомологичной рекомбинации между геномом фага Т2 и плазмидой, несущей 2 участка гомологии, фланкирующих по краям гены gp37 и gp38, принадлежащие фагу PP01. Таким образом, рекомбинантный фаг T2ppD1 несет гены фага PP01 (gp37 и gp38) и обладает тем же бактериальным тропизмом, что и фаг PP01, теряя при этом способность инфицировать те бактерии, которые мог поражать фаг Т2 в неизмененном состоянии (E. coli K-12) [131]. Этим же подходом воспользовалась исследовательская группа под руководством Mahichi, увеличив диапазон антибактериального действия фага Т2. Так как фаг IP008 имеет более широкий спектр воздействия, чем Т2 (инфицирует 33% бактерий E. coli, изолированных из проб субстратов внешней среды, против 7%, инфицированных фагом Т2), гены gp37 и gp38 фага Т2 рекомбинантно замещались гомологичными генами фага IP008, вследствие чего модифицированный фаг T2 приобретал тропность к бактериям, характерную для фага IP008 [61].
Также был разработан гибрид фагов Т3 и Т7 (T3/7), в котором часть гена хвостовой части фага Т3 (gp17) замещена таковой от фага T7. Рекомбинантный фаг T3/7 обладал более широким спектром антибактериального действия и большей эффективностью адсорбции в сравнении с обоими фагами дикого типа [132]. Le с соавт. подтвердили, что бактериальная специфичность фагов синегнойной палочки также кроется в генах хвостового отростка фага [60]. Сначала они выделили спонтанно мутировавший фаг (JG004), чей тропизм оказался шире, чем у родительского фага. Анализ последовательности, которая, предположительно, составляла хвостовой ген ORF84 у спонтанно мутировавшего изолированного фага, показал наличие точечной мутации в данном гене. Тогда исследователи заменили гомологичный ген (ORF69) фага PaP1 геном «хвоста» (ORF84) от фага JG004 путем гомологичной рекомбинации, и химерный фаг получил способность инициировать образование бляшек (зон лизиса) на культурах бактерий, входящих в диапазон воздействия фага JG004 (P. aeruginosa PAO1), однако, штаммы бактерий, которые ранее могли быть инфицированы фагом PaP1 дикого типа (P. aeruginosa PA1), более не поражались рекомбинантным фагом [60].
Marzari и соавт. расширили диапазон тропизма нитевидного колифага fd, добавив к N-терминальному концу фагового гена g3p рецептор-связывающий домен нитевидного фага IKe, специфичный к N-пилям [133]. Благодаря такой модификации химерные фаги fd инфицировали штаммы E. coli, несущие N-пили [133]. Кроме того, нативный фаг fd, инфицирующий в норме бактерии E. coli, оказалось возможным приспособить для инфицирования холерных вибрионов [134], что было достигнуто путем слияния гена минорного белка оболочки фага fd (pIII) с геном orfU, нуклеотидная последовательность которого кодирует 274 аминокислоты N-терминального конца, минорного белка оболочки другого нитевидного фага — CTX-фага [134]. Рекомбинантный фаг fd-pIIICTX не только инфицировал бактерии вида V. cholerae, но и не утратил способности заражать E. coli [134].
Ando и соавт. использовали дрожжевые системы для разработки методов изменения фаговых геномов с целью модулирования тропизма фагов [85]. Ученые сконцентрировали свое внимание на фагах E.coli, высокогомологичных по отношению друг к другу, а именно — фагах Т7 и Т3. Ген 17 хвостового отростка одного из фагов (или фрагменты данного гена) замещался гомологичным участком, взятым из другого фага (возможные комбинации отражены в Табл. 1). Кроме того, авторам удалось показать, что замена генов между менее близкородственными фагами может сделать колифаги активными в отношении клебсиелл и, наоборот, модифицировать клебсиеллезные фаги таким образом, чтобы поражать бактерии E. coli (см. Табл. 1). Данная работа продемонстрировала, что сочетание синтетических фагов с одинаковым основным каркасом, но различной структурой «хвоста» может служить для борьбы со смешанными бактериальными культурами, селективно поражая среди множества бактериальных популяций специфические виды бактерий [85].
Таблица 1. Фаги, синтезированные Ando и соавт., с соответствующими генотипами и фенотипами (а)
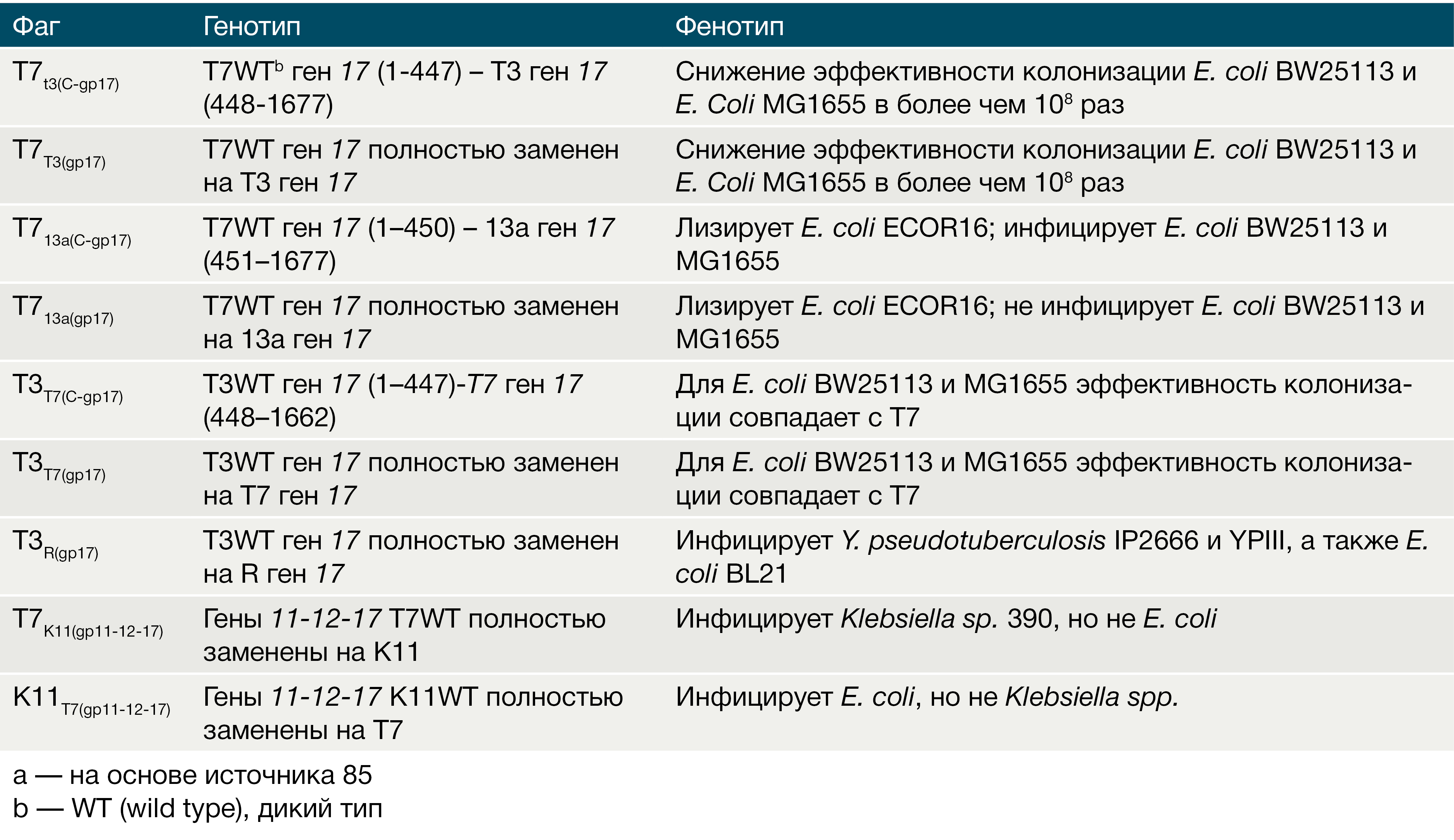
Хотя вышеописанные методы модификации позволяли варьировать спектры антибактериального воздействия для некоторых типов фагов, тем не менее стабильное систематическое и объемное производство фаговых конструкций все еще не налажено. Усовершенствование технологий генно-инженерной обработки фаговых геномов, синтеза и секвенирования ДНК обеспечит базу для подобных разработок и облегчит создание точно подобранных комбинаций фагов с модулируемым диапазоном инфицируемых бактерий. В будущем гены тропизма фагов будут собраны в базы данных нуклеотидных последовательностей, что потенциально позволит создать новые фаги с желаемыми антибактериальными свойствами за счет того, что данные гены можно будет синтезировать и объединять с хорошо известными фаговыми каркасами.
Генно-инженерные фаги, обладающие меньшей антигенной специфичностью для организма млекопитающих
Одним из вопросов, требующих решения при терапевтическом использовании фагов, заключается в нейтрализации фагов компонентами иммунной системы человека вследствие их иммуногенности [39]. На примере модельных мышей, характеризующихся системным воспалительным ответом, Hodyra-Stefaniak и соавт. продемонстрировали снижение количества активных фагов как в кровеносном русле, так и в клетках различных тканей за счет деятельности фагоцитов, антител и компонентов системы комплемента [135]. Чтобы воспрепятствовать элиминации фагов иммунной системой организма и макрофагами, входящими в ретикулоэндотелиальную систему (РЭС), Merril и соавт. внедрили технологию серийных пассажей [136]. Метод заключается в проведении серии последовательных инъекций фагов мышам, чтобы выявить мутантных фагов, которые наиболее продолжительно сохраняются в кровеносном русле [136]. Таким образом, исследователям удалось изолировать длительно циркулирующих мутантов колифагов λ. Представители двух типов фагов λ, изолированных после 10 циклов селекционного отбора, избегали фагоцитоза макрофагами РЭС в течение суток после интраперитонеального введения в 16000 и 13000 раз эффективнее, чем это делали исходные фаги λ. От исходных фагов λ оба мутантных варианта отличало наличие одинаковой мутации основного капсидного белка Е, которая представляет собой замену остатка глутаминовой кислоты остатком лизина; также в одном из мутантных фагов была обнаружена мутация капсидного белка D [136]. Метод серийных пассажей позволил также выделить длительно циркулирующих сальмонеллезных фагов P22 (инфицируют S. enterica, серовар Typhimurium), что дает надежду на возможность применения этой технологии для получения и других типов фагов, способных уклоняться от ретикулоэндотелиальной системы [136].
Лечение вирулентными (литическими) фагами может привести к массивному лизису бактерий и последующему высвобождению компонентов бактериальной клетки и токсинов, что способно активировать иммунный ответ [9, 22]. Для того, чтобы обойти эту проблему, были созданы нерепликативные (лизис-дефицитные) фаги. Например, для уменьшения выброса эндотоксина Hagens и Bläsi двумя способами модифицировали умеренный фаг М13, заставив его экспрессировать летальные белки, не приводящие к лизису бактериальной клетки [137]. Фаг M13R кодирует фермент-рестриктазу BglII, который вызывает двухцепочечные разрывы в бактериальной ДНК. Фаг M13S105 кодирует холин λ-фага (S105), приводящий к повреждению цитоплазматической мембраны. Каждый из этих фагов уменьшил количество клеток E. coli примерно на два порядка всего за 2 часа [137]. Содержание эндотоксина в надосадочных жидкостях спустя 4 часа после инфицирования E. coli фагами M13R и M13S105 возросло всего в 7 и 6 раз соответственно, что намного меньше его 27-кратного нарастания, наблюдаемого при инфицировании тех же бактерий фагом λcI– вирулентным λ-фагом, используемым в качестве контроля [137]. Однако, через 120–300 минут после заражения рост бактериальных клеток возобновился, что свидетельствует о появлении резистентных к фагам мутантов E. coli [137].
Те же авторы генетически модифицировали нитевидного фага Pf3 P. aeruginosa, заменив ген экспортного белка в геноме фага на ген эндонуклеазы BglII, в результате чего была получена лизис-дефицитная, нерепликативная, летальная модификация (Pf3R) [40]. Исследования in vitro показали, что Pf3R был летален для P. aeruginosa PAO1, так как снижал количество КОЕ на 99 % по прошествии 90 минут после инфицирования, в то время как выделение эндотоксина было минимальным. Для оценки терапевтической эффективности in vivo генно-модифицированный фаг вводился мышам через 45 минут после инфицирования P. aeruginosa [40]. Лечение с помощью Pf3R привело к выживанию 75 % мышей, в то время как мыши, получавшие Pf3 или не получавшие лечение совсем, погибли. Уровни маркеров воспаления, таких как фактор некроза опухолей альфа (TNF-α ) и интерлейкин-6 (IL-6), были в два раза выше после инфицирования мышей исходным вирулентным фагом (Pf3) по сравнению с рекомбинантным фагом Pf3R [40]. Эти результаты показывают, что созданный фаг Pf3R может эффективно лечить инфекции P. aeruginosa у мышей, обеспечивая при этом низкий уровень выброса эндотоксинов [40].
Аналогично Matsuda и соавт. [138] показали, что при лечении вызванного E. coli перитонита у мышей с помощью лизис-дефицитного фага T4LyD уровень выживаемости значительно повышался (81 % выживших за 48 часов) по сравнению с мышами, которых лечили фагом дикого типа (52 % выживших), β-лактамным антибиотиком моксалактамом (33 % выживших), или контрольной группой мышей, не получавшей лечения, которые погибли спустя 20 часов [138]. В то же время у мышей, получавших в качестве лечения T4LyD, наблюдался меньший уровень эндотоксинов и цитокинов (TNF-α и IL-6) через 12 часов после инфицирования, чем у других групп, что говорит об уменьшении системных иммунологических побочных эффектов фаговой терапии [138]. Как и в случае с результатами, полученными в исследованиях M13S105 и Pf3R, эффективность T4LyD свидетельствует о том, что преобразование вирулентных фагов в лизис-дефицитные является выгодной стратегией для ослабления побочных иммунологических эффектов фаготерапии.
В другом отчете о трансформации литических фагов в лизис-дефицитные сообщалось о модификации фага Staphylococcus aureus P954 путем гомологической рекомбинации с целью инактивации кодирования гена эндолизина, ответственного за лизис бактериальной клетки [139]. Исследования in vitro показали, что эндолизин-дефицитный фаг Р954 обладал такой же бактерицидной активностью, что и исходный фаг, и в исследованиях in vivo было выявлено, что применение модифицированных фагов в полной мере спасало мышей от фатальной метициллин-резистентной инфекции S. aureus (MRSA), хотя выраженность иммунного ответа не была описана [139].
Вышеупомянутые методы были использованы независимо друг от друга для снижения иммуногенности фаговой терапии путем нахождения мутаций и модификаций, уменьшающих либо скорость элиминации фагов при участии ретикулоэндотелиальной системы, либо объем бактериального лизиса. Остается определить, какой из этих механизмов может быть интегрирован в отдельно взятый фаг для достижения высокой эффективности лечения инфекций с одновременным ослаблением побочного иммунного ответа.
Модификация фагов для создания сиквенс-специфических антимикробных препаратов
Одна из главных проблем антибиотиков — их широкий спектр активности, который приводит к уничтожению не только определенных патогенов, но и бактерий-комменсалов [140]. Эта нецелевая активность может повредить микробиом и привести к антибиотик-ассоциированным инфекциям, таким как инфекции, вызванные Clostridium difficile [11,140]. Фаги могут быть модифицированы для уничтожения бактерий на основании их генетических особенностей, что позволяет реализовать прицельную антимикробную активность. Используя технологию CRISPR-Cas, Citorik и соавт. и Bikard и соавт. разработали противомикробные препараты, чей спектр активности может быть запрограммирован против специфических последовательностей ДНК, что позволяет уничтожать только бактерии, несущие определенные последовательности, например, плазмиды антибиотикорезистентности или вирулентности [141,142]. Этот метод, основанный на системе CRISPR-Cas, заключается в доставке РНК-направляемых нуклеаз (РНН) с помощью конъюгативных векторов или фагмид внутрь бактериальных клеток, где РНН нацеливаются на специфические последовательности ДНК и расщепляют их. Оказавшись в бактериальной клетке, РНН разыскивают специфические генетические последовательности, на которых они оставляют двухцепочечный разрыв, приводящий к гибели клетки или потере ею плазмид. В отсутствие таргетной последовательности РНН не влияют на жизнеспособность клеток [141]. Таким образом, этот метод позволяет осуществлять селективный отбор бактерий на уровне генов. Авторы создали РНН-структуры для нацеливания на blaNDM-1 и blaSHV-18, кодирующие резистентность широкого спектра и панрезистентность к β-лактамным антибиотикам соответственно. В эксперименте in vitro обработка E. coli EMG2, несущих одну из плазмид резистентности: pNDM-1 (blaNDM-1) или pSHV-18 (blaSHV-18), — соответствующей упакованной в фагмиду РНН (ФРНН) с МЗ, равной 20, снизило количество жизнеспособных клеток на 2‒3 порядка без значительного уменьшения числа клеток, не обладающих таргетными последовательностями. Более того, авторы протестировали систему против хинолон-резистентного штамма E. coli, у которых резистентность к хинолонам была вызвана однонуклеотидной мутацией ДНК-гиразы (gyrA). РНН, нацеленная на gyrAD87G, была цитотоксична для штамма E. coli, содержащего мутацию в хромосоме, но не действовала на изогенный родительский штамм. Эта система в дальнейшем была протестирована in vivo на инфекционной модели Galleria mellonella с целью определить, сможет ли она нацелиться на фактор вирулентности энтерогеморрагической E. coli O157:H7 (ЭГКП), закодированный хромосомным геном eae. Личинки G. mellonella были инфицированы ЭГКП, а при достижении МЗ=30 вводились нацеленные на eae ФРНН-структуры (ФРННeae).
Выживаемость G. mellonella при использовании ФРННeae была значительно выше, чем в контрольных группах (с использованием только буферного раствора или лечением ФРНН-структурами, нацеленными на отсутствующие последовательности ДНК) [141].
Тот же метод был применен Bikard и соавт. для селективного уничтожения антибиотикорезистентных и вирулентных штаммов S. aureus [142]. Используя систему CRISPR-Cas, они создали фагмиду, нацеленную на ген aph-3, обеспечивающий резистентность к канамицину у S. aureus. После обработки стафилококковым фагом (NM1), несущим полученную фагмиду с МЗ=20, число жизнеспособных канамицин-резистентных КОЕ S. aureus уменьшилось на 4 порядка, в то время как клетки, не являющиеся мишенями, остались нетронуты [142]. Эксперименты in vivo также проводились на мышиной модели колонизации кожи. Спустя 24 часа использования CRISPR-Cas9 фагмид, направленных против aph, популяция канамицин-резистентных S. aureus уменьшилась с 50 до 11,4 % [142]. Такой же метод был эффективен и против клинического штамма S. aureus. В этом случае мишенью фагмид были гены mecA и sek, кодирующие метициллиновую резистентность и энтеротоксин соответственно [142].
Таким образом, сиквенс-специфические нуклеазы, доставляемые фагами или фаговыми частицами, могут стать новейшими антимикробными препаратами, эффективными против появляющихся и хорошо изученных вирулентных и антибиотикорезистентных патогенов. Основной преградой для будущего применения этой технологии является обеспечение эффективной доставки РНН к большому спектру таргетных бактерий. Продолжающееся развитие основанных на фагах векторов доставки генов с регулируемым спектром хозяев может позволить преодолеть это препятствие.
Противомикробные препараты, полученные с помощью фагов
Помимо противомикробных (литических) свойств фагов и их способности доставлять антимикробные агенты, также в качестве самостоятельных противомикробных средств могут быть использованы фаговые белки [143‒145]. Если фаг инфицирует бактерию и реплицируется, закодированные им эндолизины разрушают пептидогликан бактериальной клетки изнутри. Таким образом, эндолизины начинают действовать в терминальной стадии фагового цикла репликации, приводя к лизису клетки-хозяина [146]. Несмотря на то, что обычно они проявляют свою активность внутри клеток, эндолизины могут сохранять свою активность и снаружи бактериальной клетки. В ходе эксперимента эти ферменты были экспрессированы, очищены и использованы, в основном, против грамположительных бактерий, которые из-за отсутствия у них наружной мембраны клеточной стенки чувствительнее к лизису, чем грамотрицательные бактерии [147,148]. Эндолизины, добавленные к культуре грамположительных бактерий, могут привести к их мгновенному лизису [147,149]. Более того, они успешно предотвращали и лечили вызванные грамположительными бактериями инфекции в экспериментах на животных моделях [150–155].
Фаговые эндолизины могут быть получены не только путем их естественного выделения, но и генно-инженерными методами. Например, в одном исследовании описывалось создание четырех химерных фаговых эндолизинов (Cpl-711, Cpl-771, Cpl-117 и Cpl-177) путем перестановки и комбинирования структурных элементов (каталитический домен, линкер и связывающий клеточную стенку домен) двух пневмококковых фаговых эндолизинов — Cpl-1 и Cpl-7S (синтетический вариант Cpl-7 с усиленной бактерицидной активностью) [156]. Была оценена бактерицидная активность новых химерных эндолизинов против Streptococcus pneumoniae, и самым эффективным оказался Cpl-711. Эта химерная молекула была создана из каталитического домена от Cpl-7S и полученных от Cpl-1 линкера и домена, связывающего клеточную стенку. Cpl-711 в концентрации 0,01 г/мл через 1 час после его добавления в культуру уменьшал количество клеток S. pneumoniae на два порядка, в то время как Cpl-1 снижал жизнеспособность клеток только на 15 %.
При повышении концентрации до 1 г/мл химерный фермент Cpl-711 уменьшал количество жизнеспособных клеток в пневмококковых биопленках на 4 порядка за 2 часа выдержки и оказался эффективнее исходных белков Cpl-1 и Cpl-7S, которые в тех же условиях уменьшили количество клеток лишь на 1,5 порядка [156]. По результатам исследований in vivo на мышах, инфицированных внутрибрюшинно суспензией S. pneumoniae, среди животных, получивших Cpl-711 спустя 1 час после бактериального заражения, выживаемость оказалась на 50 % выше по сравнению с мышами, которых лечили с помощью Cpl-1 [156]. Это исследование демонстрирует широкую вариативность, доступную при создании новых, усовершенствованных фаговых эндолизинов. Из-за их разнообразия при создании ферментов открываются огромные возможности для открытия новых антимикробных агентов. Похожие работы была проведены на фаговых эндолизинах, выделенных из Listeria spp. [157], Streptococcus spp. [158,159] и Staphylococcus spp. [158‒161].
Грамотрицательные бактерии сложно подвергнуть лизису из-за того, что их наружная мембрана блокирует доступ эндолизина к пептидогликану. Тем не менее, эндолизин-опосредованный лизис грамотрицательных бактерий все-таки возможен, но с помощью пермеабилизирующих (повышающих проницаемость клеточных мембран, прим. ред.) агентов [162], среди которых выделяют 2 класса:
- поликатионные агенты, такие как полимиксин и его производные, взаимодействующие с фосфолипидами клеточных мембран [163,164], или полимеры лизина, которые адсорбируются на клеточной поверхности и блокируют рост бактерий [164,165]; и
- хелаторы (комплексообразователи), такие как ЭДТА, который выводит ионы из наружной мембраны, что приводит к ее дезинтеграции [163,164], и слабые органические кислоты, проникающие в клеточную стенку и препятствующие реализации физиологических процессов бактериальной клетки [163,164]. Тем не менее, важно подчеркнуть, что токсичность пермеабилизирующих веществ in vivo может ограничивать применение этого метода. Например, и ЭДТА, и лимонная кислота оказывали цитотоксическое воздействие на макрофаги в экспериментах ex vivo [166].
Briers и соавт. объединили эндолизин EL188, выделенный из фагов P. аeruginosa, c пермеабилизаторами наружной мембраны и оценили антибактериальную активность полученного препарата в отношении нескольких штаммов P. aeruginosa. Среди протестированных пермеабилизирующих агентов были полимиксин В, поли-L-лизин, ЭДТА и лимонная кислота [164]. Тесты на антибактериальную активность in vitro указали на преимущество ЭДТА в качестве пермабилизирующего агента: комбинация эндолизина с ЭДТА всего за 30 минут снизила количество клеток P. aeruginosa PAO1, находящихся в середине log-фазы роста, более чем на 4 порядка [164]. По результатам другого исследования, в котором для повышения проницаемости мембраны также использовался ЭДТА, уменьшение количества клеток P. aeruginosa PAO1 на 3 порядка происходило спустя 30 минут при инкубации с глобулярными эндолизинами, кодируемыми геномом фагов, инфицирующих грамотрицательные бактерии [162]. Oliveira и соавт. сообщали о бактерицидном действии эндолизина сальмонеллезного бактериофага (Lys68), объединенного с органическими кислотами, в отношении грамотрицательных бактерий [167]. Наилучшие результаты были достигнуты против псевдомонадных культур: уменьшение количества клеток Pseudomonas aeruginosa примерно на 2,4, 1,5 и 3,3 порядков и клеток Pseudomonas fluorescens примерно на 1,6, 1,4, и 5,4 порядков наблюдалось в течение 30 минут после обработки культур Lys68 в комбинации с ЭДТА, лимонной или яблочной кислотой соответственно [167].
Таким образом, поиск наилучших комбинаций пермеабилизирующих веществ и эндолизина для конкретных бактерий-мишеней пока осуществляется эмпирически.Чтобы обойти проблему проницаемости наружной мембраны, Briers и соавт. создали эндолизин, содержащий ЛПС-дестабилизирующий пептид. Получившиеся эндолизины, названные артилизинами, способны проникать через наружную мембрану бактерий, чего не могут делать эндолизины природные [168]. Благодаря физико-химическим свойствам синтетических белков, связанных с эндолизинами, нарушается липополисахаридная и ионная мембранная организация, что усиливает цитолитический эффект [168]. Так, встраивание поликатионного нанопептида (ПКНП) в эндолизин OBPgp279 (получен от OBP фага P. fluorescens) усиливает бактерицидную активность нативного эндолизина против P. aeruginosa PAO1 даже в отсутствие пермеабилизирующих агентов: количество жизнеспособных клеток после обработки модифицированным эндолизином уменьшилось на 2,61 порядка, в сравнении с 1,10 порядка для природного эндолизина. Хотя ПКНП-содержащие эндолизины проявляют активность и без дополнительного повышения проницаемости мембраны, их активность усиливалась добавлением ЭДТА: количество жизнеспособных клеток PAO1 (P. аeruginosa) и Br667 (мультирезистентная P. аeruginosa) в течение 30 минут было снижено на 5,38 порядков и 4,27 порядков соответственно [168]. Для поиска генов, кодирующих антибактериальные эндолизины, Lood и соавт. создали геномную библиотеку, основанную на профагах грамотрицательных бактерий Acinetobacter baumannii [169]. Исследователи определили и выделили несколько эндолизинов, активных в отношении A. baumannii. В экспериментах in vitro было показано, что один из наиболее мощных фаговых лизинов — PlyF307, — в течение 2 часов более чем на 5 порядков снижает количество полученных из клинического изолята А. baumannii, находящихся в фазе экспоненциального роста. Обработка биопленок A. baumannii in vitro с помощью PlyF307 за 2 часа уменьшает число клеток на 1,6 порядков. Кроме того, введение эндолизина предотвращало развитие у мышей летальной бактериемии: 50 % мышей, получивших PlyF307, выжили, тогда как 90 % мышей, которым после инфицирования вводился буферный раствор, погибли в течение 2 дней. Это первое исследование, в котором изучалась эффективность нативных эндолизинов в отношении инфекций, вызванных грамотрицательными бактериями у мышей.
Создание фагов для обнаружения бактерий и диагностики
Большинство методов, используемых для поиска и определения бактериальных патогенов в продуктах питания, больницах и на производстве, отнимают массу времени — частично из-за того, что они требуют дополнительных шагов (обогащения культуры) для повышения чувствительности и/или специфичности [170,171]. Традиционный метод посева в чашках Петри не только трудоемкий, но и зачастую не позволяет определить патогены, представленные в образцах в небольших количествах [170‒172]. Другие методы, например, основанные на использовании антител, не всегда точно работают со сложными образцами без дополнительной амплификации бактериальных мишеней [173]. Такие техники, как ПЦР или гибридизационные анализы, хотя и крайне чувствительны, но не способны различать живые и мертвые клетки без обогащения бактериального материала, а также для их проведения требуется тщательный дизайн праймеров для избегания неспецифических результатов и ошибок в опознавании видов [171,173]. Недавние успехи генной инженерии и синтетической биологии, в частности, развитие фаговых инструментов для определения патогенов, сделали возможным преодоление этих ограничений.
Loessner и соавт. описали быстрый, простой и чувствительный метод с использованием генно-инженерных фагов для обнаружения Listeria monocytogenes в контаминированной пище [59]. Этот метод основан на внесении в листерийный фаг А511 с помощью гомологичной рекомбинации химерного гена luxAB, полученного при слиянии двух генов Vibrio harveyi — luxA и luxB, — который встраивается следом за геном основного капсидного белка [59]. После инфицирования бактерий вышеописанный фаг начинает вырабатывать свет. Фаговую люминесценцию можно наблюдать уже в течение 2 часов после внесения, даже если пища заражена малым количеством бактерий — 500 клеток L. monocytogenes на мл [30]. При обогащении на специальных средах бактериальные клетки обнаруживались уже в концентрации 1 КОЕ/г [59]. Sarkis и соавт. описали похожий метод определения живых микобактерий. Они вставили ген люциферазы в область тРНК генома микобактериофага L5 и использовали данный рекомбинантный микобактериофаг для определения клеток Mycobacterium smegmatis. Аликвоты культур с сотнями клеток M. smegmatis после внесения фагов дают положительный сигнал в течение нескольких часов. Таким же способом могут быть идентифицированы образцы с 12,2 и 2,7 КОЕ/100 л, но только спустя 2 или 3 дня соответственно [62].В качестве быстрого и точного способа обнаружения E. coli были предложены фаги, экспрессирующие зеленый флуоресцентный белок (GFP — green fluorescent protein) [64,65,174]. Ген gfp, изначально находящийся в составе плазмид, был внесен в геномы фагов Т4 (дикий тип), Т4е– (фаг с нонсенс-мутацией гена е) [64] и PP01 [65] с помощью гомологичной рекомбинации таким образом, что экспрессия гена gfp стала сопровождать экспрессию гена белка soc (small outer capsid protein). В результате этих манипуляций получились фаги T4wt/GFP, T4e–/GFP, и PP01-SOC/GFP (GFP был встроен в области C-терминального конца SOC) или PP01-GFP/SOC (GFP встроен в области N-терминального конца SOC) соответственно. Ген gfp был также введен в фаги IP008 и IP052 в область гена е, кодирующего фаговый лизоцим, что привело к созданию фагов IP008e-/GFP и IP052e-/GFP, оказавшихся лизис-дефицитными [174]. Инкубация T4wt/GFP со штаммом E. coli K-12 отразилась на флуоресцентной активности — она была усилена во время начальных этапов инфицирования, но затем, в результате клеточного лизиса, определение зараженных фагами клеток с помощью флуоресцентной микроскопии стало затруднительным. С другой стороны, E. coli, инкубируемая с модифицированным фагом T4e–/GFP, проявляет флуоресцентность, интенсивность которой возрастает с момента инфицирования [64]. Фаг PP01, маркированный GFP, мог специфически определять E. coli O157:H7, и флуоресценцию можно было наблюдать при микроскопии спустя всего 10 минут инкубации [65]. Усилить сигнал возможно путем создания фагов, которым присуща множественная экспрессия gfp-генов. Например, клетки E. coli Вe, инфицированные фагами IP008e-/GFP или IP052e-/GFP, проявляют слабую интенсивность флуоресценции. Когда ген gfp был добавлен к гену soc у фагов IP008e-/2xGFP и IP052e-/2xGFP, интенсивность флуоресценции была выше и усиливалась со временем [174]. Предел чувствительности этого метода еще не был оценен.Edgar и соавт. предложили систему биодетекции, комбинирующую биотинилирование сконструированных фагов in vivo с конъюгацией с покрытыми стрептавидином “квантовыми точками”, полупроводниковыми нанокристаллами, генерирующими флуоресцентный сигнал [175]. Коли-фаг Т7 был модифицирован таким образом, что на поверхности основного капсидного белка выделялся небольшой биотинилированный пептид. После размножения рекомбинантного фага в клетке бактерии-хозяина биотинилированный фаговый потомок мог быть определен благодаря флуоресцирующим покрытым стрептавидином квантовым точкам. Если бактериальной клетки не находилось, то биотинилированный фаг не воспроизводился, и функционализированные квантовые точки не связывались и смывались. Этот метод отличается быстротой, высокой чувствительностью и специфичностью: в течение 1 часа с помощью флуоресцентной микроскопии удалось определить 10 и 20 клеток E. coli в мл экспериментальных образцов и проб из окружающей среды соответственно.Piuri и соавт. генетически модифицировали микобактериофаг ТМ4 для переноса гена-репортера, индуцирующего флуоресценцию, а именно gfp, или ZsYellow [176]. Сконструированные микобактериофаги определяли Mycobacterium tuberculosis благодаря доставке генов-репортеров внутрь клеток; флуоресценция отслеживалась с помощью микроскопии или проточной цитометрии [176]. При использовании такого быстрого и чувствительного метода при микроскопировании были определены менее 100 клеток, представленных в 5-мкл аликвоте, и восприимчивость к бактериальному антибиотику могла быть определена менее чем за 24 часа, так как флуоресценция была снижена только в рифампицин- или стрептомицин-чувствительных клетках при добавлении вышеуказанных антибиотиков [176,177].Диагностические фаговые технологии постепенно начинают применяться на практике вне стен исследовательских лабораторий [173]. Например, первая диагностическая система для листерии, не требующая предварительного обогащения образцов, была недавно запущена в коммерческое производство [178]. Помимо этого, чтобы использовать фаги в качестве персонифицированных антимикробных средств в эру прецизионной медицины, необходимо быстро и точно обнаруживать патогены и определять, какие из фагов лучше подходят для терапии. Предполагается, что технологии создания фагов сыграют важную роль в разнообразных схемах лечения, когда будет необходимо быстрое обнаружение микроорганизмов.
Фаговая инженерия для системы доставки лекарств
Помимо доставки измененной ДНК, как было описано выше, фаги могут быть использованы для прицельной доставки препаратов как в прокариотические, так и в эукариотические клетки, в том числе и в клетки опухоли. Большинство исследований, проведенных на фагах в последнее время, основаны на эффективном процессе отбора, во время которого белки, способные к специфическому связыванию с таргетными клетками, выбираются из библиотеки фаговых частиц, экспрессирующих большое разнообразие функциональных пептидов на поверхности фагов [179].
Повышение активности антибиотиков
Yacoby и соавт. использовали нитевидных фагов (fd и M13) для нацеливания на S. aureus с помощью размещения специфических белков на основном белке оболочки или благодаря опосредованной антителами спецификации, которая осуществляется путем объединения иммуноглобулина G (IgG) с фагами через IgG-связывающий домен, расположенный на малом белке оболочки фага. В обоих случаях авторы химически конъюгировали фагов с хлорамфениколом, бактериостатическим антибиотиком, через неустойчивый линкер, что делало возможным контролируемое высвобождение [180]. После обработки бактерий конъюгатами фагов с лекарством фаги связывались с клетками-мишенями, и происходило высвобождение хлорамфеникола, замедляющего бактериальный рост. Однако ингибирование бактериального роста с помощью подобных конструкций предсказуемо ограничивалось гидрофобной природой хлорамфеникола, что сократило емкость фагов до менее чем 3000 молекул препарата на фаг [180]. Это ограничение позже было преодолено благодаря использованию гидрофильных аминогликозидных антибиотиков (например, неомицина) в качестве линкеров, повышающих растворимость [181]. Этот новый метод, в котором хлорамфеникол был конъюгирован через неомициновый линкер, позволил авторам загрузить более 40000 молекул антибиотика в фаг [181]. Когда такой фаг-переносчик тестировался in vitro с помощью измерения оптической плотности бактериальных культур, было обнаружено, что он ингибирует рост S. aureus, Streptococcus pyogenes и E. coli практически полностью [181]. Более того, этот метод был нетоксичен для мышей и менее иммуногенен, чем использование чистых, неконъюгированных фаговых частиц; авторы предполагают, что лекарственная конъюгация может предотвратить распознавание фагов антителами [182].
Доставка противоопухолевых препаратов
Область применения генно-инженерно и химически модифицированных нитевидных фагов не ограничивается их антибактериальными свойствами. В частности, описано использование фагов fUSE5-ZZ в качестве систем для доставки лекарственных препаратов при лечении онкологических заболеваний [183]. Эти фаги модифицировали таким образом, чтобы они представляли на своем каспиде лиганд, который придавал основному белку капсида специфичность к раковым клеткам и затем путем химической конъюгации загружался цитотоксическими препаратами (гигромицином или доксорубицином). В экспериментах in vitro данные фаги, транспортирующие лекарства, поражали клетки аденокарциномы молочной железы человека (SKBR3), для которых характерна гиперэкспрессия ErbB2. После эндоцитоза фаги разрушались, высвобождая препарат внутри раковых клеток, что приводило к угнетению роста клеток опухоли на 50 %, а также 1000-кратному увеличению активности гигромицина по сравнению с терапией препаратами без использования фага и лиганда [183].
Похожим образом Du и соавт. создали схему доставки препарата для гепатоцеллюлярной карциномы, состоящую из фага, содержащего специфичный к клеткам гепатокарциномы связывающий пептид, и доксорубицина [184]. Этот пептид был отобран методом многократного пэннинга на мышиной модели (речь идет о биопэннинге in vivo — прим. ред.) библиотек фаговых дисплеев (результат экспрессии чужеродных пептидов на поверхностных белках фагов — прим. ред.) для определения пептидных мотивов, обеспечивающих тропность фагов к опухолям [184]. Тесты противоопухолевой активности, сделанные in vivo, показали, что терапия фагами, несущими на себе лекарственные препараты, обеспечила 100% выживаемость мышей в течение 25-недельного эксперимента, в то время как среди мышей, получавших обычный доксорубицин, выживаемость составила лишь 40 % [184].
В фаговой библиотеке f8/8 был произведен поиск высокоспецифичного пептида, специфичного к клеточной линии PC-3M метастатического рака предстательной железы [185]. Специфичный к клеткам опухоли простаты фаг был выделен и преобразован в фагмиду, кодирующую экспрессию GFP под контролем цитомегаловирусного промотора [185]. Доставка и продукция GFP с помощью фагмиды наблюдались в PC-3M клетках in vitro с использованием флуоресцентной микроскопии, что подтверждает возможность использования этой методики для доставки терапевтических генов к клеткам рака предстательной железы. Wang и соавт. [186] провели скрининг фаговой библиотеки с целью выявления пептида, специфичного к клеткам опухоли молочной железы (MCF-7) и способного связываться с белком оболочки фага. Обнаруженные ими фрагменты фага были конъюгированы с доксорубицином и протестированы in vivo (на мышах). Авторами было показано повышение противоопухолевой активности комбинированного препарата по сравнению с нетаргетными препаратами и отсутствие признаков гепатотоксичности [186].
Модифицированный фаг M13 использовался in vitro для визуализации опухолевых клеток при раке простаты и для доставки к ним лекарственных препаратов [187]. Сначала геном фага M13 был обработан для отделения регуляторных элементов и кодирующих областей в генах VII и IX, которые в естественных условиях перекрывают друг друга. Таким образом эти гены могли подвергаться дальнейшим манипуляциям независимо друг от друга. К примеру, подобное реконструирование позволило авторам модифицировать N-терминальный конец белка p9, не затрагивая белок p7. На разных компонентах модифицированного фага M13 были воспроизведены 3 пептида:
- SPARC (secreted protein, acidic and rich in cysteine) связывающий пептид (SBP), представленный на минорном белке оболочки фага p3, кодируемом геном III;
- Аминокислотный мотив DFK, представленный на основном белке капсида p8, который кодируется геном VII;
- Пептид-акцептор биотина (BAP). Представлен на минорном белке капсида p9, кодируемом геном IX.
Полученному в результате модифицированному фагу был присвоен индекс M13-983. SPARC — гликопротеин внеклеточного матрикса, сверхэкспрессирующийся при многих видах злокачественных опухолей [188,189]. В свою очередь, пептидная последовательность DFK распознается катепсином Б — лизосомальной цистеиновой протеазой,избыточно продуцируемой при раке простаты [190,191]. Доксорубицин конъюгировали с радикалом аспарагиновой кислоты белка p8.
При дальнейшей подготовке M13-983 к микроскопии белок р9, содержащий BAP, ферментативно биотинилировался и инкубировался с покрытым стрептавидином контрастным веществом Alexa Fluor 488. Итоговый продукт этих манипуляций был назван фагом M13-983-Alexa-DOX [187]. Этот фаг в дальнейшем тестировался in vitro на клеточных линиях рака простаты человека, экспрессирующих SPARC с высокой (С42B) или низкой (DU145) интенсивностью. Нормированная интенсивность флуоресценции, измеренная спектрофотометром, была в 10 раз выше для клеток С42В, чем для клеток DU145, что иллюстрирует эффективность фага при таргетировании SPARC. Таким образом, была доказана эффективность данного модифицированного фага как элемента специфической визуализации. К тому же, M13-983-Alexa-DOX оказался примерно в 100 раз цитотоксичнее для клеток-мишеней, чем свободный доксорубицин [187].
Доставка антител
Frenkel и Solomon модифицировали нитевидные фаги для использования их в качестве промежуточного звена при доставке в головной мозг антител для диагностики болезни Альцгеймера [192]. Они были модифицированы для представления на своей поверхности антител к бета-амилоиду (Аß), что, в свою очередь, позволило бы выявить накопление в головном мозге Aß — белка, ассоциированного с развитием болезни Альцгеймера [193‒196]. Фаги, представляющие специфические к Аß антитела, вводились интраназально трансгенным мышам. В результате были получены данные о локализации отложений Аß, которые подтверждают факт того, что модифицированные фаги благодаря свойствам фагового вектора достигли ЦНС и прикрепились с помощью антител к Аß, причем с высокой специфичностью и без выраженной токсичности.
Факт прикрепления был подтвержден путем изготовления и окрашивания срезов мозга с использованием тиофлавина S и антифаговых антител с последующей визуализацией под флуоресцентным микроскопом [192]. Эти результаты говорят о том, что в будущем фаги могут играть важную роль в методах визуализации, в особенности если данная схема будет адаптирована под изотопы, которые уже используются in vivo для диагностической визуализации у человека [192]. Также модифицированные фаги могут быть использованы для специализированной доставки препаратов к клеткам-мишеням или внутрь их. Подобное локализованное действие препарата, возможно, позволит снизить его концентрацию при специфической терапии и общую концентрацию в организме, что приведет к уменьшению риска побочных эффектов и снижению стоимости лечения. Однако для внедрения фаговых систем доставки препаратов в широкую клиническую практику необходимо большее количество исследований фармакокинетики и иммуногенности.
Фаги и разработка вакцин
Предварительные результаты исследований сибирской язвы, вирусов иммунодефицита человека (ВИЧ) и ящура показывают, что фаги также могут полезны и при разработке вакцин. Модифицирование фагов для представления ими на своих оболочках различных антигенов позволяет создавать вакцины, которые будут отвечать постоянно растущим требованиям медицины и ветеринарии, областей, которые постоянно сталкиваются с новыми эпидемиями. Эффективная вакцина от ВИЧ может содержать множественные антигены и должна стимулировать синтез нейтрализующих антител широкого спектра действия [197,198].
Группой ученых во главе с Sathaliyawala была предложена система доставки вакцины от ВИЧ на основе фага Т4 [198]. Для создания мультикомпонентной вакцины от ВИЧ на оболочке капсида Т4 были индивидуально или в комбинации представлены до трех очищенных антигенов ВИЧ. Иммуногенность этих антигенов была протестирована на мышах, и было выявлено, что основанная на фаге вакцина вызывает сильный антительный и клеточный иммунный ответ [198]. Этот же коллектив исследователей использовал систему Т4 для представления комбинаций антигенов, полученных из токсинов сибирской язвы [199]. Т4-фаг, воспроизводящий три антигена токсинов сибирской язвы, стимулировал у мышей сильный иммунный ответ в виде выработки специфических сибиреязвенных антител. Более того, плазма крови подвергнутых воздействию мышей смогла нейтрализовать цитотоксичность летального токсина в отношении выделенных в виде клеточной линии макрофагов.
Ren c соавт. использовали основанную на фаге Т4 систему для создания вакцины против вируса ящура [200]. FMDV-T4 фаговые рекомбинантные вакцины показали свою эффективность при испытаниях на мышах, демонстрируя после пероральной или подкожной иммунизации защиту от серотипа О вируса ящура вплоть до 100 % [200]. Для гарантированной защиты от различных серотипов вируса ящура вакцинация должна проводиться поливалентными вакцинами. Перспективное преимущество этой технологии заключается в том, что она будет способствовать разработке специализированных серотипов и подсеротипов вакцин от ящура.
Генно-инженерные фаги в материаловедении
Помимо широкого применения в медицине, ветеринарии и контроле за безопасностью питания, фаги также можно использовать и в материаловедении. Путем комбинирования технологий воспроизведения фагов и генно-инженерных технологий стало возможно создание при помощи фагов наноструктурированных материалов с различными свойствами, такими как биосенсорная активность [205‒207], способность к регенерации тканей [208‒210], производство и хранение энергии [201‒204]. Четко определенная структура фага M13 и его способность представлять функциональные пептиды на своей поверхности сделали его фагом выбора, наиболее часто использующимся при создании новых материалов [201, 209, 211]. Генетически модифицированные фаги М13 были адаптированы для сборки и подготовки квантовых точек [212, 213], а также для синтеза жидких кристаллов и пленок [214‒216], производства наноколец [217] и микро- и нановолокон [218].
В 2006 году Nam с соавт. сообщили об использовании М13 для синтеза и сборки нанопроводов из оксида кобальта для производства гальванических электродов [202]. M13 был модифицирован для представления на основном белке капсида связывающих золото пептидов со сродством к ионам кобальта [202]. Затем модифицированные фаги М13 применялись для формирования нанопроводов из позолоченного оксида кобальта, что позволило увеличить емкость литий-ионных батарей [202]. Тот же коллектив ученых позже использовал созданные на основе М13 нанопровода из оксида кобальта для создания и исследования микробатарейных электродов с полноценными электрохимическими возможностями (емкость заряда и производительность) [219]. Также с помощью кобальто-марганцевых нанопроводов, созданных с применением М13, удалось сконструировать высокоемкие литий-кислородные аккумуляторные электроды [220].
Фаги М13 также служили матрицей для интеграции одностенных углеродных нанотрубок (SWNT) в фотоэлементы для повышения эффективности захвата электронов [221]. Этот метод позволил стабилизировать SWNT, сохраняя их электронные свойства и увеличивая эффективность преобразования энергии в сенсибилизированных красителем солнечных элементах (ячейках Гретцеля — прим. ред.) [221].
Материалы, созданные с помощью фагов, также могут служить и медицинским целям. Созданные с помощью фага М13 SWNT применялись для эффективных проб при неинвазивном флуоресцентном визуализировании опухолей простаты у мышей [207], а также для таргетирования SPARC и визуализации глубоких, диссеминированных опухолей в моделях злокачественных новообразований яичников на мышах [222]. Благодаря прикреплению антибактериальных антител к р3 (минорному белку капсида комплекса М13-SWNT) был получен “фаговый зонд”, который может быть использован для визуализации бактериальных инфекций in vivo [223]. С помощью данного метода был визуализирован эндокардит, вызванный S. aureus, а также с высокой контрастностью и специфичностью были обнаружены инфекции, протекающие в глубине тканей [223]. Для визуализации опухолей у мышей in vivo фаг М13 был модифицирован для представления SPARC-связывающего пептида на минорном белке капсида p3 и триглутаматного мотива на основном белке оболочки p8. Эти манипуляции производились с целью матричной сборки магнитных наночастиц оксида железа[224]. Каждая нацеленная на SPARC частица фага доставила большое количество наночастиц в необходимые клетки, что позволило существенно улучшить магнитно-резонансное контрастирование при раке предстательной железы у мышей по сравнению с традиционно используемыми в клинике наночастицами [224].
Mao с соавт. синтезировали основанные на фагах волокна и покрытия с антибактериальными свойствами путем модификации фага М13 для экспрессии на его основном белке капсида p8 отрицательно заряженного пептида, содержащего большое количество остатков глутаминовой кислоты. С помощью электростатического связывания ионов серебра, имеющих антибактериальные свойства, были созданы серебросодержащие фаговые волокна [225]. Флуоресцентное окрашивание и изучение зон гибели и подавления роста подтвердило результаты исследований in vitro, показавших, что эти созданные на базе фагов волокна демонстрируют бактерицидную активность против штаммов Staphylococcus epidermidis и E. coli. Таким образом, серебросодержащие фаговые волокна могут быть использованы как антибактериальные материалы [225].
Генетически модифицированные фаги М13 также использовались для создания инновационных материалов для регенерации тканей. Merzlyak и соавт. модифицировали фаг М13 для представления на N-конце основного белка капсида p8 клеточных сигнальных мотивов (ламининовые пептиды RGD и IKVAV) [209]. Эти фаговые строительные блоки самоорганизуются в структурированные жидкие кристаллоподобные матрицы, способные поддерживать жизнеспособность, пролиферацию и дифференциацию гиппокампальных нервных клеток-предшественников, а также контролировать их направленный рост [209]. Та же группа ученых сообщила об использовании модифицированных фагов М13 в производстве пространственно ориентированных двух- и трехмерных фаговых клеточных каркасов, которые показали хорошую цитосовместимость и поддерживали направленный рост и инкапсуляцию клеток-фибробластов [226]. Также Wang с соавт. собрали созданные на базе М13 матрицы, поддерживающие биомиметическую микросреду с контролируемыми биохимическими и биофизическими сигналами для направленной дифференциации индуцированных плюрипотентных стволовых клеток [227].
Выводы
Наступление эры синтетической биологии совместно с огромным разнообразием фагов привело к созданию большого количества продуктов для применения их в терапии, диагностике и материаловедении. Развитие новых технологий генной инженерии сделало возможным более точную и быструю модификацию геномов фагов как для фундаментальной науки, так и для прикладной генной инженерии. Фаги уже используются для создания новых антимикробных препаратов, систем доставки препаратов и вакцин, для диагностики и визуализации, а также в качестве материалов для наноприборов и тканевых клеточных каркасов.
Несмотря на вышеописанные достижения, исследования фагов еще только начинаются. Огромное разнообразие природных фаговых структур и типов еще не полностью задействовано [228, 229]. Более того, большинство встречающихся в природе фагов пока не были должным образом выделены в лабораторных условиях, а из уже открытых фагов многие еще не описаны либо пока недоступны для генетических манипуляций. Таким образом, модификация фагов затронула на данный момент лишь небольшой процент существующих фаготипов. Например, большинство решений в материаловедении основаны на фаге М13, хотя фаги с иным строением и размерами могут существенно расширить возможности практического применения фагов в этой области.
Технологии секвенирования следующего поколения [230, 231] позволяют вносить геномы или последовательности генов фагов в биоинформационные базы данных в большом количестве без необходимости предварительного выделения этих фагов в лаборатории. Данные последовательности могут быть использованы для воссоздания природных фагов путем непосредственного синтеза ДНК на основе хранящейся последовательности или для создания новых фагов из частиц уже существующих.
В дальнейшем потребуются новые технологии, с помощью которых можно ускорить цикл проектирования-сборки-тестирования фагов и эффективнее внедрять научно обоснованные фундаментальные разработки в практику.
Как было указано выше, пока отсутствуют принципы, которые можно бы было максимально быстро и с высокой надежностью приложить к широкому диапазону фагов. Многие методики модификации фагов требуют генетических манипуляций с их бактериальными носителями или возможности эффективно доставлять в них экзогенную ДНК, что пока затруднительно для многих видов бактерий. Это свидетельствует о необходимости новых инструментов для генетических манипуляций и трансформации ДНК, что сделает возможным точное и высокоэффективное внесение множественных модификаций в фаговые геномы.
В итоге большая часть разработок, освещенных в этом обзоре, привела к созданию генно-модифицированных фагов, обладающих значительными преимуществами для диагностики и лечения бактериальных инфекций, лечения небактериальных заболеваний и для создания новых материалов. Несмотря на потенциальные достоинства, признание генно-модифицированных фагов подходящими для применения в широкой практике в различных регионах мира может существенно отличаться. Методики инактивирования фагов, предотвращающие их распространение вне стен лаборатории, например, путем удаления генов незаменимого белка из генома фага и переноса их в клетку-носитель, могут помочь решить эти проблемы. В случае использования в человеческом организме важно будет учитывать не только критерии выбора данных методов в случае крайней медицинской необходимости (например, для применения против грамотрицательных патогенов, обладающих повышенной устойчивостью к антибиотикам и другим противомикробным средствам), но и четкое подтверждение их безопасности. Кроме того, уменьшить опасения относительно безопасности фагов помогут технологии с ограничением использования модифицированных фагов для диагностики и материаловедения и их инактивацией после использования. Резюмируя вышесказанное, следует сказать, что модификация фагов является областью растущего интереса и обладает большим потенциалом, однако эта сфера нуждается в большом количестве дополнительных разработок и исследований.
