Эволюция вирусов сезонного гриппа
Несмотря на десятилетия наблюдений и борьбы с применением как фармацевтических, так и нефармацевтических методов, каждый год сезонный грипп продолжает вызывать эпидемии по всему миру. Ключевой процесс, лежащий в основе повторяющихся эпидемий, — эволюция вирусов, направленная на ускользание от активного естественного (индуцированный перенесенной инфекцией) или искусственного иммунитета (индуцированный вакциной). Хотя мы начинаем понимать основополагающие процессы эволюционной динамики вирусов сезонного гриппа, но когда и как появляются новые штаммы вируса остается в большей мере непредсказуемым. В предлагаемом обзоре рассматриваются последние достижения в понимании молекулярных механизмов ускользания вирусом гриппа от иммунного ответа, способы давления естественного отбора, популяционная динамика вируса гриппа и перспективы в улучшении контроля над ним.
Вирусы сезонного гриппа заражают 5-15% популяции людей каждый год, что в результате приводит к ~500 000 смертей в мире. Ежегодное повторение сезонных эпидемий связывают с непрекращающейся эволюцией вирусов сезонного гриппа. Она позволяет уходить от активного иммунного ответа как естественного, связанного с перенесенной инфекцией, так и искусственного, вызванного вакциной.
Эволюция способствует эффективной передаче вируса от человека к человеку воздушно-капельным путем, через прямой контакт, а также опосредованно через фомиты (предметы, бывшие в контакте с патогенными микроорганизмами). Вакцины против вируса гриппа эффективны в профилактике распространения эпидемий вируса сезонного гриппа, однако они должны регулярно обновляться, чтобы не отставать от эволюции вирусов. Вирусы гриппа принадлежат к семейству Orthomyxoviridae, их геном представлен отрицательно полярной одноцепочечной сегментированной РНК. Основные возбудители сезонных вспышек — вирусы гриппа типы А и В (вирус типа С также распространяется среди людей, но вызывает менее тяжелые формы болезни). Вирус гриппа А людей зародился у птиц и свиней. За первой встречей и последующей адаптацией к людям последовали глобальные пандемии (например, пандемия “испанки” в 1918 году и “свиного гриппа” в 2009 году) с последующим распространением в популяции людей в виде сезонного гриппа. Грипп А подразделяется на подтипы в зависимости от сочетания двух гликопротеинов на поверхности вируса: гемагглютинина (HA) и нейраминидазы (NA) (рис. 1а).
На сегодняшний день выделено 18 подтипов по HA и 11 по NA, большая их часть распространена среди диких птиц, известно лишь 3 комбинации, широко распространенные среди людей: A/H1N1, A/H2N2 и A/H3N2. Сейчас из этих трех A/H1N1 и A/H3N2 ответственны за сезонные эпидемии гриппа. Вирус гриппа В (примечание 1), не имеющий животных резервуаров, распространен среди людей, по крайней мере, с 1940 (тогда впервые был выделен вирус гриппа В), хотя, вероятно, существовал у людей задолго до этого. Грипп В делится на два основных рода (B/Victoria и B/Yamagata), которые разошлись в 1970х.
Геном вирусов гриппа А и В представлен 8 сегментами, включающих полимеразные гены:
- polymerase basic 1 (PB1),
- polymerase basic 2 (PB2),
- polymerase acidic (PA),
которые кодируют вирусную РНК-зависимую РНК-полимеразу (RdRP) и другие белки, предположительно отвечающие за индукцию клеточной гибели (например, PB1-F2 (прил. 8)) и регуляцию вирусной патогенности (например, PA-X9):
- Nucleoprotein (NP), который кодирует вирусный нуклеопротеин;
- Matrix (M), который кодирует белок вирусного матрикса (М1), а также вирусный поверхностный белок (М2), работающий как ионный канал;
- Nonstructural (NS), который кодирует как nonstructural 1 (NS1), участвующий в уходе от иммунной системы, так и nuclear export protein (NEP, также известный как NS2), который является посредником экспорта комплекса вирусного рибонуклеопротеина;
- HA и NA, которые кодируют основные поверхностные гликопротеины (рис. 1а).
HA отвечает за прикрепление к клетке за счет связывания с сиаловой кислотой на ее поверхности и последующее проникновение посредством слияния мембран. NA разрезает связи между HA и сиаловыми кислотами, способствуя выходу новых вирионов из инфицированных клеток, что позволяет вирусу двигаться через слизистую оболочку. Путем копирования ошибок в нуклеотидной последовательности вирусной RdRP в ходе репликации генома и благодаря сегментарному строению их генома, вирус гриппа эволюционирует, постепенно накапливая мутации (антигенный дрейф) и подвергаясь рекомбинации генома, также известной как пересортировка (антигенный шифт).
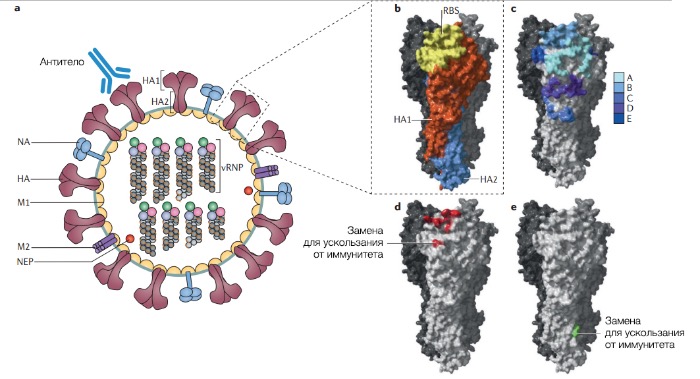
b | HA — гомотример, каждый мономер которого состоит из 2 доменов: HA1 (оранжевый) и HA2 (голубой). HA1 составляет большую часть шаровидной головки и содержит рецептор-связывающий участок (RBS) для прикрепления к клетке. HA2 составляет белковую основу домена ножки.
c | Приведены пять классических антигенных участков H3 HA (обозначаемые A-E), открытых при помощи моноклональных антител и выборки кристальных структур белка — все они изменяются в ходе эволюции.
d | Иллюстрируются участки замен для ускользания, ответственные за большую часть всех антигенных преобразований вируса гриппа A, а также гликопротеины H3 HA и NA подтип 2 (A/H3N2) с 1968 по сегодняшний день.
e | Зеленым цветом помечены замены в домене ножки (аминокислоты 387 и 391), которые доказали свою роль в ускользании H3 подтпа HA от перекрестно нейтрализующих анти-HA антител. M1 — белок матрикса.
Любой подтип вируса, постепенно накапливая нуклеотидные мутации и аминокислотные замены в поверхностных гликопротеинах HA и NA, время от времени дает начало новому антигенному варианту вируса (именуемый “штаммом”, особенно, когда речь идет о разработке вакцины) — феномен, известный как “антигенный дрейф”. Такие прерывистые антигенные изменения, в особенности в HA, позволяют вирусу ускользать от иммунитета, вне зависимости от того, индуцирован он перенесенной инфекцией или вакциной. Таким образом, вирус способен повторно заражать людей, которые были к нему однажды иммунны, что требует пересмотра состава вакцин против сезонного гриппа. Из-за прерывистого характера антигенной эволюции антигенную изменчивость структуры вирусного гликопротеина можно представить в виде кластеров. Это явление породило концепцию антигенных кластеров.
Касательно кластерного вида антигенной эволюции стоит отметить, что антигенная изменчивость по большей части оценивается при помощи реакций торможения гемагглютинации (РТГА). Едва ли этими реакциями можно выявить все виды антигенных изменений, так как они основываются на антителах, блокирующих связывание с сиаловыми кислотами. Иные механизмы антитело-зависимого ответа (антитело-зависимая или комплемент-зависимая цитотоксичность и антитело-зависимый клеточный фагоцитоз) также могут играть роль во время инфекции. РТГА не позволяет судить обо всех возможных изменениях, с учетом которых отображение антигенной эволюции не было бы столь прерывистым. Действительно, даже при использовании лишь РТГА можно найти примеры, когда умеренные мягкие антигенные колебания, зафиксированные вне значимых кластерных преображений, приводят к появлению новых антигенных вариантов вируса, замещающих старые. Новые антигенные варианты гриппа A/H3N2 появляются каждые 3-5 лет, тогда как гриппа A/H1N1 и В — реже (2-5 лет для A/H3N2 в сравнении с 3-8 годами для A/H1N1 и B). Вирусы сезонного гриппа повсеместно вызывают эпидемии, заражая сотни миллионов людей каждый год (каждый человек, вероятно, переносит инфекцию несколько раз за всю жизнь). Удивительно, что его антигенные варианты появляются так часто. В этом обзоре авторы рассматривают, почему вирусы гриппа эволюционируют медленно — концепцию, которая стоит в противовес общему предубеждению о быстром изменении вирусов гриппа. Авторы обсудят последние достижения в понимании процессов, которые определяют скорость антигенного дрейфа, в том числе молекулярные основы антигенной эволюции, естественный отбор внутри хозяина, передачу между хозяевами и популяционную эпидемиологию. В обзоре останавливаются на том, как различные эволюционные и экологические предпосылки препятствуют образованию новых генетических вариантов, лежащих в основе изменения вируса, лишая естественную эволюцию возможностей для отбора. В конце будут рассмотрены перспективы улучшения контроля вируса гриппа путем вакцинации и предсказания хода вирусной эволюции.
Молекулярные основы антигенного дрейфа
Белок HA — основная цель человеческого приобретенного иммунитета и ключевой компонент вакцин против вируса гриппа. HA представляет собой гомотримерный белок, каждый из мономеров которого состоит из 2 доменов: шаровидной головки (globular head, HA1) и ножки (stalk, HA2) (рис. 1b).
Десятилетия исследователи ставили своей главной задачей определить молекулярные детерминанты антигенного дрейфа. В прорывных исследованиях 1980-х при помощи моноклональных антител к структурам белка HA на шаровидной головке удалось определить 5 заметно различных антигенных участков, каждый из которых состоял из множества аминокислотных остатков (рис. 1с). В этих работах было выдвинуто предположение, что для возникновения нового антигенного варианта вируса необходима замена по крайней мере одной аминокислоты в каждом из участков. В то же время в другой работе считали, что один из участков, вероятно, иммунодоминантный, но лишь недавно появилось более точное определение молекулярных детерминант антигенного дрейфа.
В одном из последних исследований при помощи РТГА, анализа бляшкообразования и реакции микронейтрализации было выявлено, что основными детерминантами антигенных изменений вируса гриппа A/H3N2 с 1968 по 2003 год являются 7 аминокислот HA, расположенных вокруг рецептор-связывающего участка (позиции 145, 155, 156, 158, 159, 189 и 193 в H3). Замены одной из них достаточно для образования нового антигенного варианта, однако штаммам с определенным генетическим происхождением требуется 2-3 мутации. Антигенные варианты вируса A/H3N2, которые определяли после 2003, содержали изменения в этих же 7 позициях. У вирусов птичьего A/H5N1, свиного A/H3N2 и лошадиного A/H3N8 гриппа также была доказана важность небольшого числа аминокислотных позиций, примыкающих непосредственно к рецептор-связывающему участку, в формировании антигенной эволюции. Однако, аминокислотные замены, отдаленные от рецепторного домена HA, включая замены, которые нельзя отследить при помощи наиболее используемых методов, также могут играть важную роль в ускользании от иммунного ответа. Недавнее исследование аминокислотных замен в HA, связанных со способностью ухода от иммунного ответа, при помощи методики глубокого сканирования мутаций (deep mutational scanning) подтвердило значение одноаминокислотных замен. Методика также выявила зависимость: определенные аминокислотные остатки в каждой из позиций определяют степень ускользания от того, чтобы быть распознанным специфическим антителом.
Многие вопросы касательно эволюции и эпидемиологической динамики вирусов гриппа В остаются без ответа. Например, почему вирусы гриппа В эволюционируют медленнее? Было предложено множество гипотез о медленной эволюции вируса В, включая гипотезу о менее склонной к ошибкам вирусной РНК-зависимой РНК полимеразы (RdRP), о более низкой иммуногенности в сравнении с вирусами А и относительно низкой авидности к сиаловым кислотам. Популяционные механизмы также могут иметь важное значение: маленькие и более редкие эпидемии, в основном, среди детей, которые раньше инфекцию не переносили — все это дает меньше возможностей для реализации давления сил естественного отбора на вирус.
Практическое значение имеет вопрос: какой из двух штаммов вируса гриппа В (B/Victoria или B/Yamagata) будет доминировать в следующем сезоне. Большинство вакцин в мире трехвалентны и состоят из одного представителя A/H1N1 вируса, одного A/H3N2 вируса и либо B/Victoria, либо B/Yamagata. С 2000 по 2010 вакцина верно попадала в штамм вируса гриппа В лишь 50% сезонов, что значительно снижало ее эффективность. Недавно были введены четырехвалентные вакцины, включающие оба вируса А и В, но пока их применяют не так широко. Следующая проблема производства как трех-, так и четырехвалетных вакцин - это использование яиц для выращивания вируса. По крайней мере с 2004 выращивание вирусов гриппа В в яичной среде ведет к потере участков гликозилирования в HA. Такая потеря изменяет антигенность и, соответственно, влияет на эффективность вакцины. Проблема существует до сих пор, о чем свидетельствует слабая реакция антисыворотки хорьков против вирусов, выращенных на основе яиц, в сравнении с вирусами, выращенными в культуре клеток.
У людей старшей возрастной группы антитела к ножке белка HA, значительно менее представленные по сравнению с антителами к шаровидной головке, выделяют чаще. Антителам легче достичь эпитопов шаровидной головки, нежели эпитопов ножки, которые от иммунной системы спрятаны лучше. Чтобы выработались антитела к ножке, необходимо перенести инфекцию несколько раз. Эти антитела представляют значительный интерес, поскольку область ножки HA подвергается меньшей изменчивости среди подтипов вируса, следовательно, антитела к ножке могли бы предоставить широкую защиту от нескольких подтипов сразу. Редко сообщают о сведениях антигенного ускользания от антител к ножке, но возможно, это связано лишь с тем, что на ножку HA из-за недоступности и небольшой распространенности антител к ней силы естественного отбора не оказывают своего давления. В экспериментах in vitro при помощи замены всего одной аминокислоты (особенно через замену Q387K у вирусов A/H3N2) можно достичь ускользания от антител к ножке.
Во время инфекции гриппа вырабатываются также антитела к NA, тормозящие репликацию вируса и уменьшающие тяжесть заболевания у мышей и у людей. Однако антигенная изменчивость NA изучена не так подробно, как HA, который привлекал внимание исследователей по нескольким причинам: HA иммунодоминантен, потенциал анти-HA антител выше; помимо этого, антигенность NA изучать фенотипическими методами сложнее. Как и у HA, антигенную эволюцию NA можно представить кластерами, но появление новых антигенных вариантов NA во времени не связано с дрейфом HA. Зарегистрированные вакцины против вируса гриппа на сегодняшний день содержат иммуногенные концентрации NA, однако значение NA в эффективности вакцины неизвестно, более того, сама иммуногенность NA может быть снижена в процессе производства вакцины из-за низкой термостойкости белка.
Сдерживающие факторы вирусной эволюции
Учитывая, что для образования новых антигенных вариантов вируса гриппа необходимо столь малое число аминокислотных замен, странно наблюдать их появление лишь раз в несколько лет. За последние десять лет было выдвинуто несколько гипотез о взаимодействии вируса и хозяина, объясняющих, почему новые антигенные варианты появляются так редко. После выявления семи аминокислотных позиций, близлежащих к рецептор-связывающему участку, отвечающих за антигенные изменения в вирусе A/H3N2, появилась гипотеза о ключевом ограничителе иммунного ускользания. Обман антител к рецептор-связывающему участку требует деликатного подхода: мутации в этих позициях не должны нарушить рецепторной способности. При любом таком случае незначительное количество замен в каждой из позиций способно позволить избежать иммунного ответа, сохранив рецепторную функцию. Эта гипотеза могла бы объяснить любопытное эволюционное событие в истории вируса сезонного гриппа A/H1N1, когда между 2006 и 2007 каждый из трех антигенно схожих, но географически изолированных родов по HA вируса, приобрели одинаковую аминокислотную последовательность и сформировали один новый одинаковый антигенный вариант. Эта замена, K140E, прилегающая непосредственно к рецептор-связывающему участку, структурно не отличима от участков, которые обнаружили у вируса A/H3N2 (рис. 1с).
Авидность рецептора к сиаловой кислоте, вероятно, также играет важную роль в сдерживании скорости антигенной эволюции, особенно при условии, что старый и новый антигенные варианты вируса тем более схожи, чем больше помех рецепции создают аминокислотные замены вокруг рецептор-связывающего участка. Связывание с сиаловой кислотой — ключевой момент проникновения вируса в клетку, поэтому HA подтипы вируса с низкой авидностью к сиаловым кислотам хуже переносят аминокислотные замещения вблизи от рецептор-связывающего участка, чем вирусы с более высокой авидностью. Такой баланс между рецепцией и иммунным ускользанием, скорее всего, значимо сдерживает антигенный дрейф, что могло бы объяснить относительную единообразность успешно распространяющихся антигенных кластеров.
Принадлежность к определенному генетическому штамму, вероятно, является главной детерминантой толерантности к такого рода аминокислотным заменам. Экспериментальные работы на NP и NA показали, что даже близкородственные вирусы отличаются по способности переживать определенные замещения. В одном теоретическом исследовании, в котором применяли динамические моделирование эпидемиологии и эволюции гриппа, выявили, что только множественные мутации могут привести к последовательности замен, изменяющих антигенность, но не затрагивающих приспосабливаемость вируса — такая необходимость может серьезно сдерживать эволюцию. В более новой работе по теоретическому моделированию предположили, что сдерживают антигенные изменения отрицательные мутации, снижающие адаптацию вируса, поскольку они требуют того, чтобы аминокислотные замены не только изменяли антигенность HA, но и повышали приспособляемость вируса, таким образом компенсируя накапливающиеся отрицательные мутации.
Даже в отсутствие этих сдерживающих факторов, возможности иммунного отбора повлиять на ускользающий вариант невелики. Вероятно, это связано с тем, что для того, чтобы начали преобладать силы отбора варианты, образованные в процессе антигенного дрейфа, должны достичь достаточной плотности. Гипотетическая оценка факторов, формирующих эволюцию вируса внутри хозяина, дает основания полагать, что острое течение инфекции гриппа в совокупности с низкой вероятностью появления мутантного вируса и сдерживающими силами врожденного иммунитета (смотри раздел “Давление естественного отбора”), сводит шанс появления антигенных вариантов вируса, находящихся под давлением естественного отбора внутри хозяина, к минимуму (шанс выше при затянувшемся течении у иммунноскомпроментированных лиц). Например, скорость появления мутаций у RdRP вируса гриппа A находится в пределах от ~2.0 × 10-6 до ~2.0 × 10-4 мутаций на каждый участок в один цикл репликации генома. Таким образом, вероятность формирования нового варианта в процессе антигенного дрейфа посредством однонуклеотидных мутаций ~2/105 (обратная функция от среднего двух значений скорости выше) на один цикл репликации. В инфицированной клетке, синтезирующей ~104 вирионов, даже если новый вариант возникнет в первом цикле репликации, остальное потомство, появившееся в этой клетке, будет значительно превосходить числом. После выхода из клетки дочерним вирусам еще предстоит пережить систему мукоцилиарного клиренса, прежде чем они подвергнутся действию отбора антителами. Такая иммунная защита, скорее всего, значительно ослабит популяцию вновь сгенерированного варианта, и лишь незначительная часть вирусного потомства заразит соседние клетки (рис. 2)
Давление естественного отбора
Основу давления отбора на антигенность вируса гриппа составляет активный иммунитет либо естественный, либо искусственный. О существовании отбора посредством иммунитета свидетельствует то, что за появлением новых антигенных вариантов вируса следует исчезновение старых. Однако механизмы отбора внутри хозяина, лежащие в основе таких наблюдений, остаются не до конца ясными. Недавнее исследование, в которое вошло 166 испытуемых, не обнаружило значимого влияния вакцинации и перенесенных инфекций на появление новых антигенных вариантов.
Чтобы понять, как именно работает иммунный отбор, придется учесть скоротечность и распространенность инфекции, а также соответствующую роль врожденного и приобретенного иммунитета как у “наивных”, так и у уже болевших индивидов.
Отбор, обусловленный врожденным иммунитетом
У людей, прежде не сталкивавшихся с антигенами вируса гриппа (“наивные” индивиды), инфекцию в значительной степени сдерживает врожденный иммунитет. При первой встрече с вирусом слизистая оболочка формирует богатый сиаловыми кислотами защитный слой, который работает как приманка: связывает значительное количество вирусов, эффективно снижая, таким образом, инфицирующую дозу. После заражения клеток хозяина вирусом запускается опосредованный толл-подобными рецепторами и интерферонами сигнальный ответ, который быстро приводит соседние клетки в противовирусное состояние, резко ограничивая репликацию вируса. Эффективность отбора врожденным иммунитетом зависит от многих факторов: инфицирующей дозы, иммуногенности вируса, которая обусловливает провоспалительные процессы, а также генетических особенностей реактивности врожденного иммунного ответа. Суммируя, врожденный иммунный ответ сдерживает эволюцию вируса, вне зависимости от его антигенного фенотипа, ограничивая количество клеток, работающих на нужды вирусной репликации — это значительно уменьшает многообразие вирусов, на котором возможен естественный отбор.
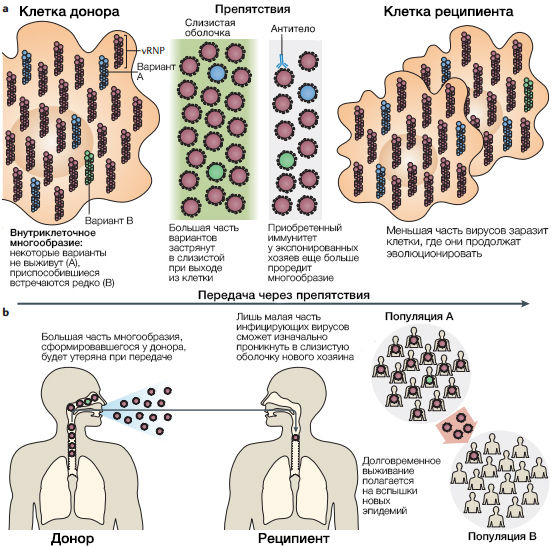
b | Факторы распространения вирусов гриппа между хозяином и популяцией включают выход из клеток донора, инфицирование хозяина и распространение эпидемии. Большая часть вирусного многообразия, сформировавшегося в инфицированных клетках хозяина будет утеряна при передаче, т.к. лишь малое число вирусных частиц достигает нового хозяина и заражает его. Тот же самый процесс работает на популяционном уровне: долговременное выживание вируса полагается на то, что вирусу удасться из одного региона эпидемии распространиться в другой и начать эпидемию там. Как и препятствия при передаче между отдельными хозяевами, так и сходный процесс на эпидемическом уровне, вероятно, существенно снижает многообразие вируса. vRBP, вирусный рибонуклеопротеин.
Отбор, обусловленный приобретенным иммунитетом
Повторяющиеся вакцинации и эпидемии гриппа вместе собираются в сложную мозаику взаимодействия антител и иммунных клеток памяти, влияющих на давление отбора со стороны иммунитета. Сила иммунного отбора для любого индивида складывается из анамнеза перенесенной инфекции или вакцины, антигенного соответствия имеющихся антител к инфицирующему вирусу, а также давности выработанного иммунитета, снижающегося со временем (иммунологическое затухание), что может привести к ослаблению отбора, несмотря на предшествующие встречи с антигеном.
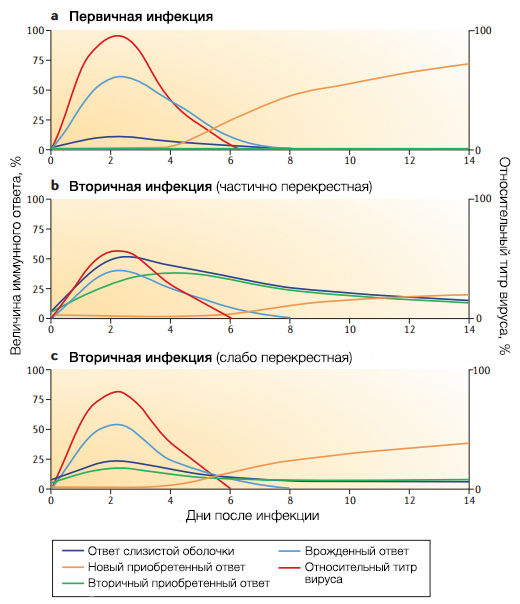
a | Представлена первичная инфекция у “наивного” к вирусу гриппа индивида. Активация интерферонового ответа взаимосвязана с репликацией вируса гриппа и составляет основу раннего иммунного ответа. Это время, которое необходимо для первичного ответа B-лимфоцитов, соответствует динамике антиген-специфической активации зачаточного центра лимфатического фолликула и занимает 6 дней от экспозиции к антигену. Небольшой ответ слизистой оболочки может быть обусловлен реакцией естественных антител типа иммуноглобулины M.
b | В случае вторичной инфекции вариантом частично перекрестным со старым антигенным вариантом иммунный отбор работает на основе перекрестных серологических и B-лимфоцитарных реакциях. В сравнении с первичной реакцией преимуществ больше. Как и в части a формирование специфического приобретенного иммунного ответа происходит после пика вирусной репликации. Однако формирование антител к штаммам, которые подверглись действию антигенного дрейфа, ограничено активностью перекрестно реагирующих антител, которые связываются с головкой HA и снижают количество антигенов, способных выработать новый специфический ответ.
c | В случае вторичной инфекции новым антигенным вариантом с низкой перекрестной активностью к предшествующему вирусу, нейтрализация вируса существующим приобретенным иммунитетом минимальна, и вирус реплицируется до титров сходных с первичной инфекцией (как в части a). Новый антиген экспонируется достаточно, чтобы спровоцировать новый B-лимфоцитарный ответ, специфичный к новому варианту. Таким образом, чем меньше штаммы сходны, тем больше активируются новые иммунные реакции (антигенная отдаленность).
У “наивных” индивидов вирусы, которым удалось избежать врожденного иммунного ответа, успешно реплицируются, достигая максимального титра через 24-72 часа от заражения, в зависимости от заражающей дозы (рис. 3а). Однако выработка вирус-специфичных антител de novo занимает 7-10 дней от заражения, поэтому силы антигенного отбора вируса во время первичной инфекции минимальны. Более того, острое течение гриппа ведет лишь к кратковременной экспозиции антигенов вируса врожденному иммунному ответу. Необходимо длительное присутствие антигена, чтобы выработались высокоспецифичные антитела. Предполагается, что понадобится более одной инфекции или вакцинации, чтобы сформировать такие антитела и обеспечить защиту. Отсюда следует, что детская заболеваемость, несмотря на повсеместность, играет ограниченную роль в эволюции вируса.
После первичной инфекции последующие встречи со знакомыми антигенными вариантами вызывают в слизистой оболочке иммунный ответ на распознанные эпитопы вируса. Такая реакция в основном обусловлена антителами типа иммуноглобулина А (IgA) в верхних дыхательных путях. IgA способны проникать из кровеносного русла сквозь эпителиальные барьеры в просвет верхних дыхательных путей, где они нейтрализуют вирус гриппа, предотвращая заражение клеток хозяина (процесс называется “иммунное изгнание”). До тех пор, пока есть вирус-специфичные антитела, сформировавшиеся после перенесенного заболевания, инфекция может быть быстро подавлена без привлечения дополнительных сил иммунитета. Это объясняет, почему с каждой последующей инфекцией гомологичными штаммами вируса серологические реакции ослабевают. Однако такой ответ, вероятно, успешно отбирает новые антигенные варианты в инокуляте, составляя основу естественного отбора в эволюции вируса на популяционном уровне человека.
Повторные заражения лишь частично перекрестными антигенными вариантами обычно ведут к незавершенной ранней нейтрализации антителами с развитием инфекции. Поскольку каждая инфекция гриппом сопровождается общим призывом клеток памяти, то, как правило, наибольшего титра достигают те антитела, которые сформировались в более раннем возрасте. Такое иммунологическое подкрепление ведет к т.н. антигенному старшинству вариантов вируса, встреченных в первые 10 лет жизни. Это явление согласуется с гипотезой о “первородном антигенном грехе”, которая говорит, что призыв иммунологической памяти препятствует выработке высокоспецифичных антител к новому антигенному варианту вируса. Во время инфекции, контролируемой преимущественно иммунными клетками памяти, существует вероятность того, что иммунный отбор сработает в пользу появления новых антигенных вариантов de novo, однако процесс сдерживают типично острое течение инфекции, преобладание субнейтрализующих антител и поредевшая популяция вирусов, на которую будет влиять отбор.
Заражение отличным от прежних антигенным вариантом, который слабо активирует иммунную память и редко подвергается действию существующих антител, — в большей мере прерогатива врожденного иммунитета, вне зависимости от антигенных особенностей вируса. Как и в случае “наивных” индивидов, отбор вирус-специфичными антителами скорее всего начнет работать только при повторной экспозиции из-за разницы во времени пика вирусного титра и реакции приобретенного иммунитета (рис. 3с).
Оценка иммунного отбора
Титр противогриппозных антител и их перекрестную реакцию с новыми вирусами обычно измеряют для оценки потенциальной защиты от инфекции гриппа. В совокупности с описанием многообразия вирусного генома серологические реакции позволяют пролить свет на иммуноопосредованную эволюцию вируса. Необходимо учитывать то, что в большинстве случаев грипп ограничивается верхними дыхательными путями. Антителам для того, чтобы они оказали на новый инфицирующий вариант давление отбора, необходимо оказаться в просвете верхних дыхательных путей к началу инфекции. Способность проникать сквозь эпителиальные барьеры к месту инфекции присуща не всем антителам, в большей мере ей обладают IgA антитела (и в меньшей IgG антитела в легких). Таким образом, мощная активация иммунитета и высокие титры антител в сыворотке не являются прямым отражением антитело-опосредованного отбора вирусов гриппа в месте инфекции, т.к. лишь малая часть антител по настоящему имеют доступ к этой области. Последние исследования показали, что титр антител в сыворотке слабо коррелирует реакцией иммунитета на инфекцию. Можно заключить, что титр антител в сыворотке переоценивает силу иммуноопосредованного отбора. Чтобы сполна оценить вклад иммунологической памяти в слизистой оболочки и ее вероятную роль в эволюции вируса, не достает понимания, как специфичные к вирусу гриппа клетки памяти развиваются и остаются в тканях.
Динамика распространения между хозяевами и эпидемий
Новые антигенные варианты, с большой долей вероятности, могут быть утрачены при передаче последующим хозяевам, если изначально не реплицируются до больших количеств в организме инфицированного индивида. Популяция вирусов сталкивается с препятствиями на этапе выхода из организма донора, попадания в организм реципиента и врожденного иммунного ответа при проникновении в слизистую оболочку — все это приводит к заметным потерям в сформировавшемся вирусном многообразии (рис. 2b). Вклад каждого этапа разнится в зависимости от пути передачи: заражение воздушно-капельным путем представляет большую проблему, чем контактная передача. Равно как выживание внутри хозяина и передача между отдельными индивидами, так и развитие полномасштабной эпидемии представляет эволюции вируса гриппа непростую задачу. Сезонный характер и небольшая продолжительность эпидемий гриппа с учетом огромного разнообразия вирусов, распространенных в одной эпидемии, не оставляют времени вновь образованным вариантам на то, чтобы в борьбе на выживание с предшественниками реплицироваться до количеств, способных привести к последующим эпидемиям.
Время наступления сезонных эпидемий гриппа в мире неодинаково. В регионах с умеренным климатом эпидемии происходят чаще зимой, а в тропиках — в периоды дождей (хотя время наступления в тропических странах также разнится) (рис. 4а). Экспериментальные работы на животных моделях показали, что передача вируса воздушно-капельным путем происходит эффективнее при более низких температурах и относительной влажности окружающей среды в сравнении с более высокой температурой и влажностью. Это объясняет сезонность эпидемий в умеренных широтах Северного и Южного полушарий. Однако во многих тропических регионах эпидемии гриппа совпадают с местными сезонами дождей, во время которых высоки и температура, и влажность, а значит в этих регионах прямая контактная передача и передача через фомиты, вероятно, играет более важную роль, чем воздушно-капельная передача. Если это действительно так, то в условиях тропиков контактная передача, по сравнению с более проблематичной воздушно-капельной, преобладающей в умеренном климате, способствует ускоренной эволюции в популяции. Начало эпидемий также связывают с колебаниями абсолютной влажности.
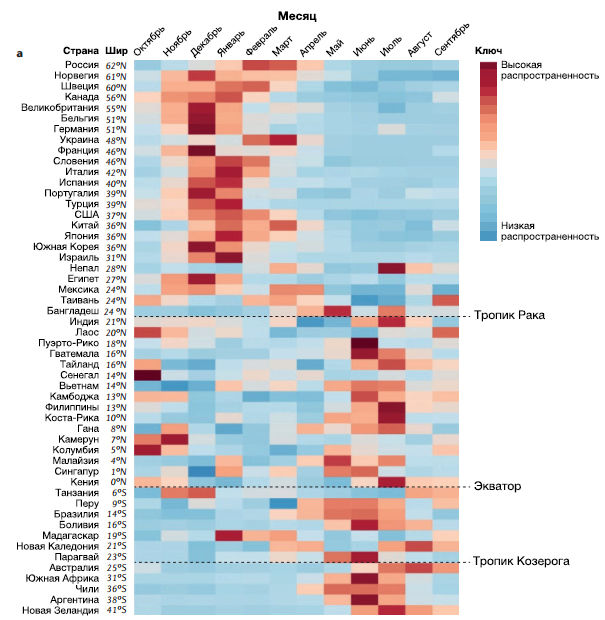
b | Стрелками обозначены значения скорости миграции вируса в регион на основе филогенетических выводов, полученных по данным секвенирования HA вирусов гриппа. Толщина линии соответствует средней скорости миграции вируса за год. Стрелки обозначают тенденцию направленности вирусной миграции. Круги для каждой области обозначают вклад каждого региона во всемирную родословную вируса. Круги помечены разными цветами, чтобы ориентироваться в регионах по миру, но никак более не помогают интерпретировать график. Африку невозможно было включить в график из-за слаборазвитой системы наблюдения по сравнению с остальным миром. Шир — широта. Часть b предоставлена с разрешения Macmillan Publishers Limited.
Зимние эпидемии в умеренном климате и в сезоны дождей в тропиках также можно связать с изменениями поведения людей, например, с увеличением времяпрепровождения в помещениях. О немаловажной роли скученности людей в замкнутых пространствах свидетельствуют эпидемии гриппа в домах престарелых и тюрьмах в летнее время и эффективность карантина в школах в ограничении передачи вируса. Помимо этого сезонные колебания иммунитета, в особенности на период зимы, когда провоспалительные реакции находятся в состоянии повышенной регуляции, также могут обусловливать сезонность эпидемий гриппа.
Всемирная динамика
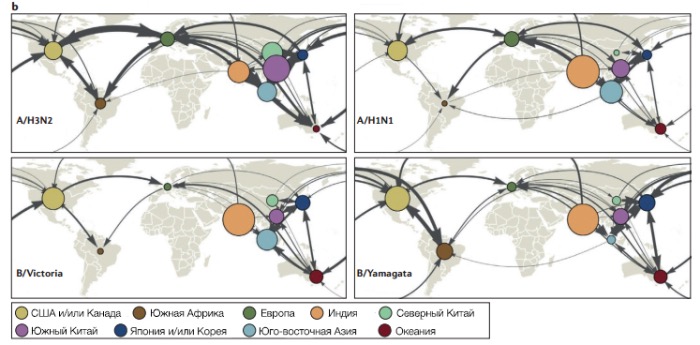
Долговременное распространение вирусов гриппа в человеческой популяции в условиях быстротечных эпидемий опосредовано глобальной миграцией вируса. Международное передвижение вируса и его локальная персистенция между эпидемиями вызывала интерес с 19 века. Выдвигались различные гипотезы, пытавшиеся объяснить мировую миграцию вируса, в том числе его способность возвращаться в уже пройденные умеренные регионы Северного и Южного полушарий из-за разницы наступления зимы по времени, а также ежегодное распространение эпидемий из тропиков и Китая в умеренные регионы. Исторические наблюдения распространения пандемий вируса из Китая, а также банальные масштабы человеческой популяции в стране, поддерживают гипотезу о Китае как об источнике вируса.
Филогенетический анализ вирусного генома по базам данных Нью-Йорка (США), представляющей Северное полушарие, а также Южного острова (Новая Зеландия) и Австралии, представляющих Южное полушарие, не подтвердил идею о локальной персистенции гриппа A/H3N2 между эпидемиями. Последующие исследования также свидетельствовали о локальном вымирании вирусов между эпидемиями, а также определили, что Восточная и Юго-Восточная (В-ЮВ) Азия — глобальный источник вируса A/H3N2. Поступившие результаты наблюдений из Индии (box 2) подтвердили роль В-ЮВ Азии, вдобавок было открыто, что Индия — также источник вируса A/H3N2. В В-ЮВ Азии и Индии вирус A/H3N локально вымирает между эпидемиями, однако колебания местных климатов позволяют вирусу непрерывно распространяться от эпидемии к эпидемии в разных регионах. Недавно выявили, что закономерность глобального распространения сезонного гриппа изменяется в зависимости от скорости антигенной эволюции различных типов и подтипов вируса. В отличие от вируса A/H3N2, глобально распространяющегося каждый год из В-ЮВ Азии и Индии, вирусы гриппа A/H1N1 и B в виде нескольких параллельно существующих генетических родов спорадически персистируют между эпидемиями в нескольких регионах мира. От этих параллельных родов периодически дивергируют новые антигенные варианты, что требует индивидуального подхода к разным регионам в подборке компонентов вакцины к вирусу гриппа B.
Особенности всемирного распространения сезонного гриппа, вероятно, связаны с различиями в скорости вирусной эволюции, что также объясняет разницу распределения заболеваемости в разных возрастных группах. По всей видимости, вирусы, которые эволюционируют достаточно быстро, чтобы избежать иммунного ответа, заражают людей всех возрастов чаще, нежели медленнее эволюционирующие вирусы, которые преимущественно инфицируют детей и лишь спорадически взрослых. Например, в антигенных регионах по гликопротеину HA вирусы A/H3N2 эволюционируют быстрее, чем вирусы A/H1N1 и B в своих антигенных регионах. Эта разница в скорости эволюции и обусловливает более частые эпидемии вируса A/H3N2 (что, в свою очередь, также толкает эволюцию вперед), а также вовлеченность всех возрастов. Вирусы A/H1N1 и B не вызывают таких больших и частых эпидемий, а заболевают, в основном, дети. Учитывая также то, что взрослые путешествуют чаще детей, разница в распределении заболеваемости по возрастам определяет сходные закономерности распространения вирусов A/H3N2, A/H1N1 и B, но более быстрое движение вируса A/H3N2.
Возможности регулирования гриппа
Вакцины — основное средство профилактики и регулирования сезонных вспышек гриппа. В сравнении с самой заболеваемостью, вакцины, скорее всего, не сильно влияют на вирусную эволюцию: менее 10% всей популяции в мире регулярно вакцинируются против гриппа. Однако эволюция вируса значимо снижает эффективность вакцин. В соответствии с этим, состав вакцины пересматривается дважды в год (в феврале в Северном полушарии и в сентябре в Южном полушарии), чтобы убедиться, что вирусы в вакцине соответствуют распространенным вирусам, которые, вероятно, вызовут будущую эпидемию. Такие решения принимают приблизительно за 9 месяцев до того, как она начинает фактически защищать, поскольку требуется время на ее разработку, распространение и внедрение. Длительное производство во многом связано с технологией получения вакцины на основе куриных яиц. Это дает вирусу время эволюционировать, чтобы появились новые варианты — “окно возможности”, которое часто снижает эффективность вакцины. Производство на основе яиц также может непреднамеренно провоцировать антигенное изменение вируса в составе вакцины: вирус человека начинает эволюционировать с тем, чтобы эффективнее реплицироваться в яйцах. Новые методы получения вакцины (Таблица 1), основанные на более эффективных процессах производства, могут сгладить эти огрехи и дать более эффективную вакцину. Сегодня вакцину можно получить на основе культуры клеток или при помощи рекомбинантных технологий без выращивания вируса на питательной среде яиц. Таким образом можно получить в вакцине вирус, генетически более схожий с диким типом, и снизить вероятность эволюции вируса в ходе лабораторного производства. Рекомбинантные технологии позволяют начать производство вакцины, как только геном вируса секвенирован, и вместо того, чтобы выращивать живой микроорганизм в яйцах или культуре клеток, получить готовый препарат в значительно более короткие сроки. Если бы большая часть вакцин производилась рекомбинатным способом, то состав штаммов можно было бы выбирать незадолго до внедрения вакцины, частично закрыв таким образом “окно возможности” для появления новых антигенных вариантов в популяции людей.
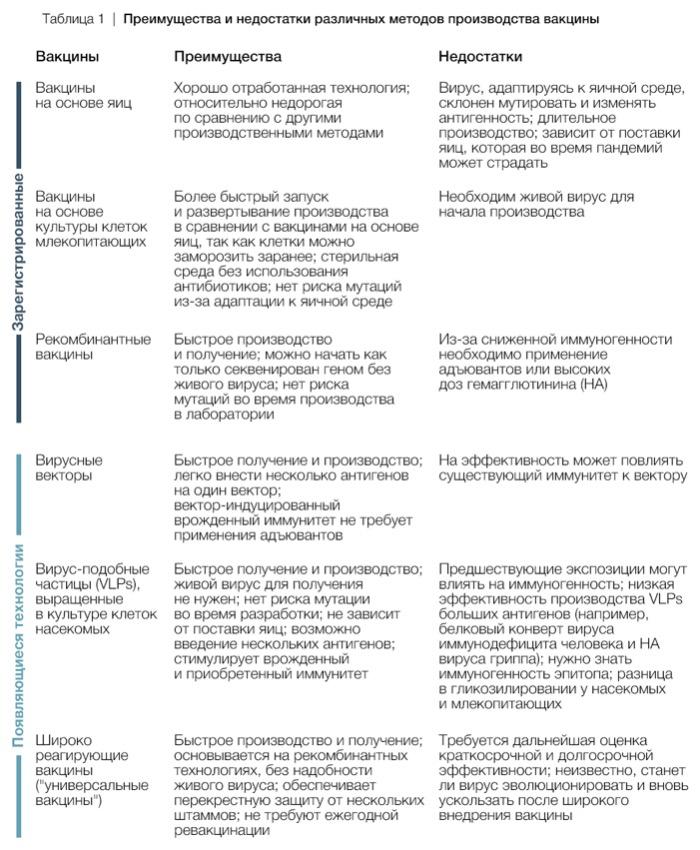
Дополнительно улучшить производство вакцины можно было бы попытавшись предсказать закономерности эволюции вируса. Возможность предсказывать, куда пойдет эволюция вируса, значительно расширила бы возможности разработки вакцин и повысила их эффективность. На сегодняшний день ограниченное понимание влияния генотипа на фенотип вируса и взаимодействия факторов, регулирующих скорость антигенной эволюции, не позволяет точно предсказать будущие антигенные изменения вируса. Последние достижения продвинули возможности предсказывать ход генетической эволюции вируса при помощи анализа данных секвенирования генома и закономерностей филогенетического ветвления. Стало возможным определить успешность генетических родов: какие ветви выживут, а какие вымрут. Точность таких предсказаний стала выше после внедрения данных об антигенном составе. Эти методы в содействии с инструментарием, отслеживающим эволюцию гриппа в реальном времени, (например, NextFlu) помогают совместить данные наблюдений разного рода (в особенности, данных антигенного состава). Потенциально это поможет выбирать штаммы для включения в вакцины. Необходимо также пересмотреть, как используются вакцины для поддержания иммунитета. Ежегодные ревакцинации против гриппа могут отрицательно сказываться на эффективности, поскольку повторное привлечение однажды сформированных клеток памяти не стимулирует новые иммунные реакции. Снижение эффективности повторных вакцин со временем связано со снижением выработки антител с каждой последующей экспозицией к сходным вирусам и разницей между вирусом в вакцине и диким типом. В общем, существует 4 стратегии для решения этих проблем: формировать нейтрализующий ответ к консервативным эпитопам, чтобы снизить необходимость в ревакцинации (т.е. создать универсальную вакцину); усилить иммунный ответ в слизистой оболочке, чтобы обеспечить перекрестную защиту; вакцинировать вирусами, не схожими по антигенному составу с прежде распространявшимися вирусами для того, чтобы посредством иммунологического подкрепления обеспечить защиту от диких штаммов; усовершенствовать адъювантный состав вакцины, чтобы способствовать выработке новых иммунных ответов. Дополнительно эффективность вакцины можно повысить, если обновить стратегии отбора штаммов для нее. Выбор штамма основан главным образом на реакциях связывания с антисывороткой хорьков, первично инфицированных гриппом. Такая оценка не учитывает всю сложность иммунных реакций на множественные инфекции и вакцинации в анамнезе и не точно отражает защиту индивидов, сталкивающихся с инфекцией несколько раз, особенно у пожилых. Появляющиеся технологии фенотипирования иммунитета и методов нового поколения секвенирования типичных антител продвигают понимание процессов защиты, позволяют более взвешенно выбирать штаммы для вакцин и лучше защищать людей, множество раз переболевших или вакцинированных.
Заключение
В данном обзоре обсуждаются механизмы, которые работают в тесной взаимосвязи на уровне вируса, хозяина и популяции людей, определяя скорость эволюции вируса гриппа. В свою очередь, эволюция движет глобальную динамику сезонного гриппа. Несмотря на высокую заболеваемость каждый год, возможности давления естественного отбора реализуются редко. Обстоятельства, ограничивающие отбор, связаны прежде всего с биологией вируса (незначительное количество мутаций, не снижающие существенно выживаемость вируса), иммунитетом (повторные экспозиции тормозят новые иммунные реакции) и эпидемиологией (быстротечность инфекции и эпидемий).
Изучение эволюционных процессов подкрепляется сейчас все возрастающим разрешением секвенирующих инструментов нового поколения, которые используют для идентификации мутаций, возникающих внутри хозяина (within‑host) и при передаче между хозяевами (between‑host). В особенности, это касается появления новых мутантов de novo и их избирательных преимуществ избежать вероятностную гибель. Растет потребность в улучшении вычислительных и математических возможностей моделирования, чтобы учитывать данные о процессах внутри хозяев и при передаче между ними от разных источников. Более того, чтобы продвинуться в понимании эволюции вирусов сезонного гриппа, важно стандартизировать данные разных лабораторий и вести обмен первичными вирусологическими сведениями не только о секвенировании, но также об антигенной структуре вирусов.
Иммунное секвенирование с целью выделения типичных иммунных “профилей” во время инфекции и вакцинации может привести к открытию маркеров иммунного ответа хозяина, общих для лиц определенных групп. Такое открытие позволило бы подойти систематически к описанию естественного отбора вирусов на уровне хозяина и популяции. Общие маркеры иммунитета можно было бы использовать для предсказания эффективности вакцины еще на стадии разработки. Однако, использование таких широкомасштабных подходов в разработке вакцины против гриппа требует понимания того, как изменения в вирусном генотипе влияет на специфический иммунный фенотип.
Улучшение нашего понимания эволюции вируса гриппа и способность прогнозировать закономерности развития вируса улучшит контроль за эпидемиями. Но поскольку вирус гриппа является глобальным патогеном, необходимо вводить новые меры по борьбе с вирусом во всем мире. На сегодняшний день производство вакцины против вируса сезонного гриппа составляет 500 миллионов доз в год для населения >7 миллиардов человек. Чтобы бремя вируса гриппа не было таким тяжелым, придется значительно увеличить производство вакцины, доступ к ней, к антивирусным препаратам и нефармацевтическим вмешательствам. Это особенно важно для стран со слабой системой здравоохранения.
Глоссарий
Эпидемия — вспышки инфекционного заболевания, поражающие большое количество человек в определенном географическом местоположении в течение определенного периода времени.
Фомиты — поверхности или предметы, которые могут быть загрязнены патогеном
Пандемия — всемирная эпидемия инфекционного заболевания
Рекомбинация генома — вид генетической перестройки, когда два или более вируса гриппа поражают одну и ту же клетку и обмениваются сегментами генома, что приводит к формированию нового вируса
Антигенные кластеры — набор вариантов вируса гриппа со сходным антигенным строением
Реакция торможения гемагглютинина — экспериментальная оценка антигенных характеристик вируса на основе способности сыворотки хозяина тормозить агглютинацию эритроцитов, вызванную вирусом
Отбор внутри хозяина — естественный отбор на уровне отдельного хозяина, связанный приспосабливаемостью вируса и его взаимодействием с иммунными реакциями
Иммунодоминатность — свойство, определяющее реакцию иммунной системы в первую очередь на данный антиген
Реакции бляшкообразования — экспериментальные реакции, оценивающие скорость репликации вируса
Реакции микронейтрализации — экспериментальные испытания, которые оценивают способность сыворотки хозяина нейтрализовать определенные антигенные штаммы
Глубокий анализ мутаций — экспериментальный протокол оценки мутабельности и влияния аминокислотных замен на определенные участки белков или на целые белки.
Эпитопы — части антигена, распознаваемые антителами хозяина
Антигенность — качественная характеристика восприятия антигена иммунной системой
Авидность — степень связывания антигена с рецептором через множественные химические связи
Динамические модели — математическая абстракция поведения объекта в системе на протяжении времени
Мукоцилиарный клиренс — удаление патогенов за счет движения реснитчатых клеток слизистой оболочки в верхних дыхательных путях
Инфекционная доза — количество патогенных частиц, которые инициируют инфекцию
Антигенная отдаленность — мера антигенной схожести, оцениваемая по разнице результатов реакции торможения гемагглютинина
Иммунологическое затухание — явление снижение титра антител или общей иммунологической реактивности в отсутствие стимуляции со временем
Иммунологическое подкрепление — обращение иммунитета к прежде выработанным клеткам памяти при контакте с частично перекрестным антигеном вследствие инфекции или вакцинации
Антигенное старшинство — явление, которое характеризуется большим титром антител к тем вариантам вируса гриппа, с которыми иммунитет столкнулся в молодом возрасте
Препятствия (“пробки”) — сокращение многообразия из-за уменьшения популяции в количестве
Адъювант — фармакологический агент, который действует на широту и/или силу иммунного ответа
Антисыворотка — сыворотка крови со специфическими для данного патогена антигенами.
