Некодирующие РНК и заболевания: тёмная материя генома

В генетике долгое время существовала концепция «один ген ㅡ один белок». Результаты проекта «Геном человека» (1990–2004) показали её несостоятельность: генов, кодирующих белки, оказалось в 2–3 раза меньше, чем самих видов белков — не так уж редка ситуация «один ген – несколько белков». Однако на этом странности не закончились. Оказалось, что как минимум 2/3 генома белки вообще не кодирует! В данном случае ДНК таких «странных» генов либо совершенно не подвергается транскрипции (считыванию РНК), либо РНК с неё считываются, но белок по таким РНК не синтезируется.
Именно последний вариант мы и рассмотрим в этой статье, посвящённой некодирующим РНК и их роли в заболеваниях человека.
Некодирующие РНК (нкРНК, в англоязычной литературе — non-coding RNA, ncRNA) — это молекулы рибонуклеиновых кислот, которые не подвергаются трансляции, то есть по их последовательности не синтезируются белки. В геноме человека число генов некодирующих РНК превышает число белок-кодирующих генов (~23 000 и ~20 000, соответственно, согласно базе данных GENCODE, январь 2017) [1]. Если же учесть тот факт, что транскрипции подвергается не вся ДНК, а примерно 50–80% генома, то преобладание некодирующих последовательностей становится гораздо более впечатляющим: лишь 2% из образующихся РНК транслируется в белки, а оставшиеся 98% приходятся на нкРНК [2–4]. Основные виды некодирующих РНК, число их генов и год открытия перечислены в Таблице 1, а схематичное строение и основные функции некоторых нкРНК представлены на Рисунке 1.
Таблица 1 ❘ Виды некодирующих РНК.
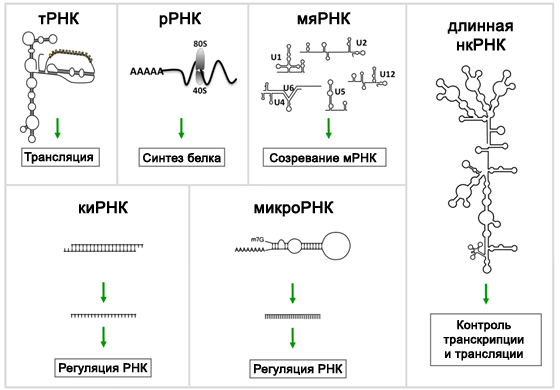
Рисунок 1 ❘ Основные виды некодирующих РНК [7].
Помимо перечисленных в Таблице 1 и на Рисунке 1, к регуляторным нкРНК относятся и многие другие типы РНК (рис.2). Например, среди малых нкРНК присутствуют РНК, взаимодействующие с белками PIWI (пиРНК, piwi-interacting RNA, piwiRNA), киРНК с натуральным антисмысловым транскриптом (natural antisense short interfering RNA, natsiRNA) и другие. Однако эти виды некодирующих РНК не обнаружены в клетках человека, и/или их патогенетическое и диагностическое (а также терапевтическое) значение ещё не показано, поэтому здесь мы их не рассматриваем.
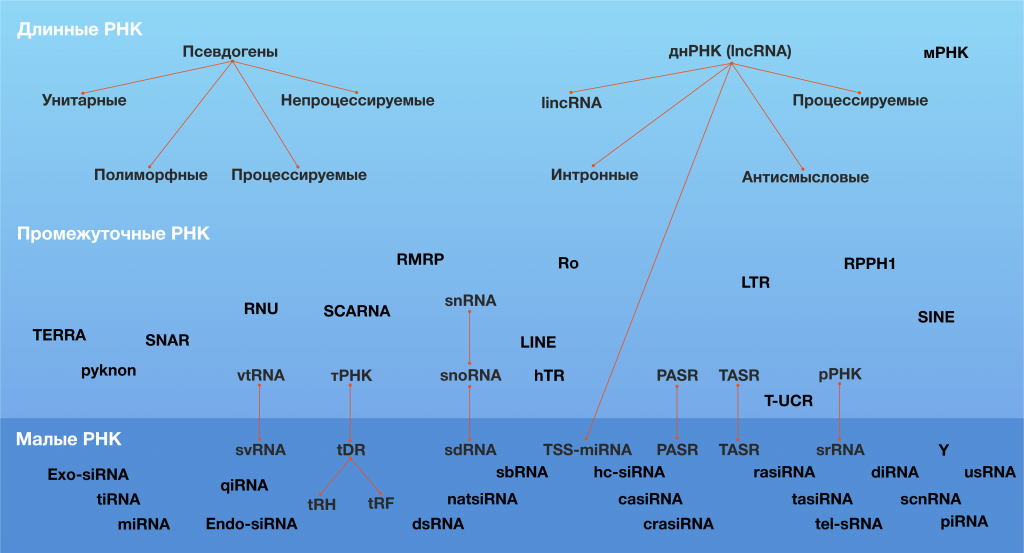
Рисунок 2 ❘ Некодирующие РНК [8].
Но какую же роль играют эти РНК, если они не кодируют белки?
Некодирующие РНК могут выполнять либо инфраструктурные, либо регуляторные функции. К инфраструктурным некодирующим РНК относят рРНК, тРНК и малые ядерные РНК [4]. Для синтеза белков они необходимы не меньше, чем матричная РНК (мРНК), несущая информацию о необходимой последовательности аминокислот: рРНК являются компонентом рибосом, непосредственно синтезирующих белки, а тРНК «подносят» к рибосомам аминокислоты из которых и синтезируется полипептидная цепь. Малые ядерные РНК участвуют в сплайсинге (процесс удаления интронов из незрелой мРНК) и регуляции РНК-полимеразы II — фермента, осуществляющего транскрипцию предшественников мРНК, микроРНК и самих мяРНК [7]. Гены рРНК, тРНК и мяРНК относятся к генам «домашнего хозяйства» (housekeeping genes), и мутации в них несовместимы с жизнью.
Регуляторные некодирующие РНК можно разделить на малые (20–400 нуклеотидов) и длинные (от 200–400 до десятков тысяч нуклеотидов) [2–4,9]. Все они участвуют в модификации других РНК и играют важную роль в регуляции экспрессии генов на разных уровнях.
Напомним, что понятие «экспрессия» объединяет все процессы, благодаря которым по информации, закодированной в конкретном гене (последовательности нуклеотидов ДНК), синтезируется либо некодирующая РНК, либо белковый продукт. Регуляции могут подвергаться такие составляющие процесса экспрессии, как метилирование генов, транскрипция, трансляция, сплайсинг РНК и посттрансляционные модификации белков.
Процесс экспрессии некодирующих РНК также управляется на транскрипционном или посттранскрипционном уровне (после стадии транскрипции), при этом регуляторами могут выступать другие нкРНК (рис. 3), благодаря их способности взаимодействовать с ДНК, РНК и белками [3].
Рисунок 3 ❘ Взаимная регуляция ДНК, различных видов РНК и белков [7].
Хотя функциональная значимость установлена лишь для 1% всех длинных нкРНК человека, то есть примерно для полутора сотен видов молекул [2,4], показано, что они играют важную биологическую роль. Например, длинная регуляторная нкРНК под названием Xist участвует в процессе инактивации одной из двух Х-хромосом у млекопитающих женского пола [2]. К слову, Xist является самой длинной некодирующей РНК — её длина составляет 17 000 нуклеотидов! [10] Xist функционирует на уровне организации хроматина, однако прочие длинные нкРНК способны регулировать экспрессию генов и на других уровнях: транскрипции, сплайсинга и посттранскрипционных процессов (Рис.3). Механизмы этой регуляции различны: одни нкРНК способствуют усилению взаимодействия нуклеиновых кислот с белками; другие функционируют как молекулярные «ловушки» или «губки» для белков и микроРНК, захватывающие молекулы и предотвращающие их взаимодействие с другими компонентами молекулярных путей [3,4]. Отметим, что регулировать некоторые процессы, происходящие после этапа транскрипции, способны и малые РНК.
Малые регуляторные нкРНК вовлечены во многие физиологические и патологические процессы: пролиферацию, дифференцировку и апоптоз клеток, секрецию инсулина, биосинтез холестерина и др. [11]. Обнаружено, что все малые РНК функционируют на основе механизма РНК-интерференции (Рис. 4). Кстати, за открытие этого механизма американские исследователи Эндрю Файер (Andrew Fire) и Крейг Мелло (Craig Mello) в 2006 году получили Нобелевскую премию по физиологии и медицине.
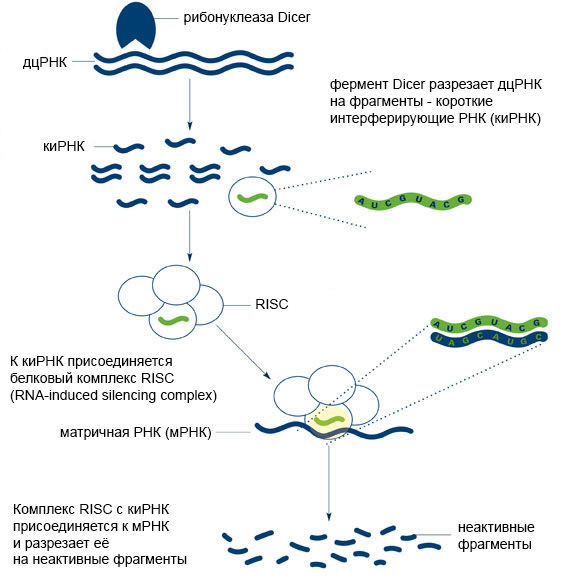
Рисунок 4 ❘ Принцип РНК-интерференции [12]
Суть РНК-интерференции заключается в подавлении экспрессии гена на посттранскрипционном уровне (после синтеза мРНК), при активном участии малых молекул РНК – киРНК или микроРНК.
МикроРНК постоянно присутствуют в клетках человека, а вот киРНК в норме не встречаются, как и их предшественники — двуцепочечные молекулы РНК (дцРНК). Такие необычные виды РНК могут оказаться в клетке при её заражении некоторыми вирусами или при введении искусственных генетических конструкций (трансгенов). Если в клетке появляется дцРНК, фермент (дцРНК-специфическая рибонуклеаза) Dicer узнаёт её и «нарезает» на фрагменты, которые и представляют собой короткие интерферирующие РНК.
Далее, в ходе РНК-интерференции, одна из цепей киРНК (в её роли может выступать и одноцепочечная микроРНК) вступает во взаимодействие с комплексом белков под названием RISC (RNA-induced silencing complex). Вторая цепь киРНК при этом деградирует [13,14]. Одноцепочечные микроРНК также способны участвовать в процессе РНК-интерференции. Однако комплексу RISC сложнее взаимодействовать с микроРНК, поэтому последние оказываются гораздо менее эффективными регуляторами посттранскрипционной экспрессии [15].
Центральным элементом комплекса RISC является эндонуклеаза Ago2 – фермент, расщепляющий нуклеиновые кислоты. В том случае, если цепочка киРНК, связавшаяся с комплексом RISC, окажется полностью комплементарна какой-либо мРНК – эндонуклеаза разрежет эту мРНК по месту комплементарного связывания. Нарезанные фрагменты функционально неактивны и к тому же быстро разрушаются ферментами клетки [14].
Если же в комплекс RISC встраивается не киРНК, а микроРНК, то полная комплементарность уже не является необходимым условием для взаимодействия с мишенью. Чаще всего, достаточно комплементарности лишь 2–8 нуклеотидов (из 19-24), формирующих так называемый «seed region». Благодаря малому размеру этого региона одна микроРНК может иметь много мРНК-мишеней. При неполной комплементарности микроРНК и мишени последняя остаётся целой, однако её трансляция становится невозможной – рибосома дойдёт до того места, где присоединился комплекс, и прекращает синтез белка [2,14].
Можно заметить, что, хотя и киРНК и микроРНК участвуют в процессе интерференции, действуют они с некоторыми отличиями. Рассмотрим их подробнее.
Короткие интерферирующие РНК:
- Не имеют собственных генов; представляют собой фрагменты более длинных дцРНК.
- Абсолютно комплементарны мРНК-мишени.
- Запускают разрушение мРНК-мишени; НЕ подавляют её трансляцию.
- Функции — защита клетки от чужеродного генетического материала (вирусов, трансгенов), регуляция некоторых генов.
МикроРНК:
- Считываются с собственных генов.
- Большинство микроРНК комплементарны мРНК-мишени не полностью, а лишь в seed region.
- Подавляют трансляцию мРНК-мишени ИЛИ активируют её разрушение.
- Функции — регуляция генов-мишеней.
Считается, что микроРНК способны управлять экспрессией до 30% всех белок-кодирующих генов [2,4,11]. Тем самым эти малые нкРНК регулируют многие процессы жизнедеятельности клеток: пролиферацию, дифференцировку, апоптоз и др.
И малым и длинным некодирующим РНК свойственна тканеспецифичная экспрессия, когда каждый отдельный тип нкРНК преобладает в какой-либо одной ткани организма [4]. Так, miR-1 чаще других микроРНК встречается в мышечной ткани, в том числе и в сердце, а miR-122 с большей вероятностью обнаружится в гепатоцитах [11]. Нарушения экспрессии нкРНК сопровождают многие заболевания, в том числе онкологические и наследственные, хотя в большинстве случаев неясно, является ли изменение экспрессии причиной или следствием болезни [2].
К изменению уровня экспрессии — то есть снижению или усилению синтеза микроРНК- могут приводить внешние факторы, например, ионизирующая радиация или воздействие перекиси водорода [11]. Под их воздействием или спонтанно могут происходить мутации генов микроРНК, химические модификации ДНК и гистонов, активация генов транскрипционными факторами [4]. Всё вышеперечисленное способно нарушать экспрессию микроРНК, вызвать увеличение или снижение количества молекул микроРНК в клетке, ослабление или усиление экспрессии мРНК-мишеней, а также может привести к появлению новых мишеней у микроРНК. Такие клеточные процессы могут отразиться и на здоровье человека – от появления незначительных особенностей фенотипа до развития тяжёлых болезней [2].
Взаимосвязь нарушений экспрессии нкРНК со различными заболеваниями настолько актуальна и интенсивно исследуется, что этой теме посвящают не только отдельные статьи, но и целые выпуски журналов (например, выпуск Journal of Human Genetics от января 2017 под названием «Dysregulated Non-coding RNAs and Human Diseases: A Fine-Tuner Changes into a Confuser»). Перечислим лишь несколько примеров доказанной взаимосвязи нкРНК и заболеваний.
Делеция гена miR-17 вызывает дефекты роста и развития скелета. Мутация, затрагивающая seed region miR-96 вызывает наследственную прогрессирующую потерю слуха, а аналогичное повреждение гена miR-184 приводит к развитию наследственного кератоконуса, которому предшествует полярная катаракта [16]. Нарушение экспрессии некодирующих РНК (микроРНК и длинных нкРНК) обнаружено при злокачественных опухолях, поражениях сердечно-сосудистой системы, нейродегенеративных процессах [17,18]. К примеру, при миодистрофиях Дюшенна и Беккера изменяется уровень сразу нескольких микроРНК — miR‑146b, miR‑155, miR‑214 и miR‑221/222. Показана ассоциация miR‑155 и гипертонии, miR‑17, miR‑20а и легочной гипертензии, а также изменение экспрессии таких длинных нкРНК, как aHIF, ANRIL, KSNQ10T1, MIAT и MALAT1 при инфаркте миокарда [4,16,18].
Некоторые регуляторные нкРНК могут функционировать как онкогены — усиление их экспрессии ассоциировано со злокачественным перерождением, пролиферацией и миграцией опухолевых клеток. Как правило, в таком случае эти нкРНК подавляют экспрессию генов-супрессоров опухоли. Например, избыточный синтез miR-21, наиболее известной и изученной онкогенной микроРНК, ингибирует экспрессию PDCD4 – белка, стимулирующего апоптоз («запрограммированную смерть») раковых клеток. Другие микроРНК способны играть роль опухолевых супрессоров и подавлять другие онкогены. Пример — miR-34, которая останавливает пролиферацию, блокируя регуляторы клеточного цикла, и стимулирует апоптоз [4,16,18,19]. Механизмы действия онкогенных и онкосупрессорных микроРНК и длинных нкРНК показаны на Рисунке 5.
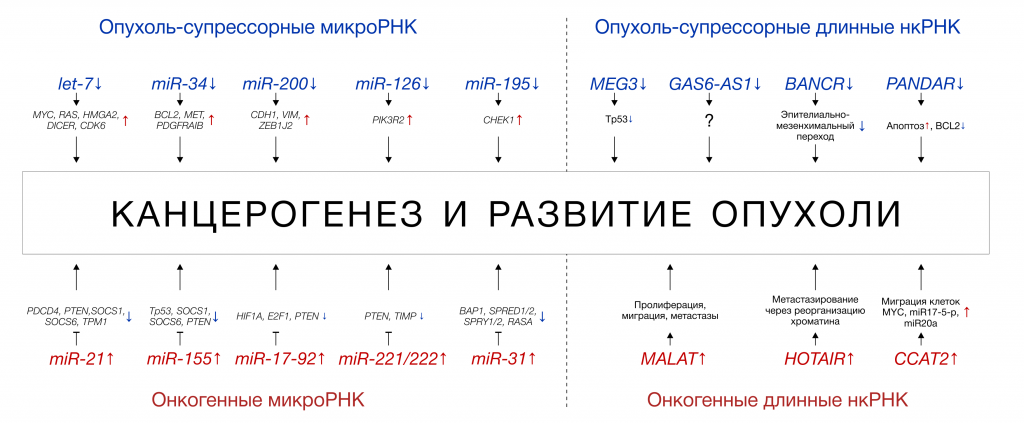
Рисунок 5 ❘ Молекулярные механизмы действия нкРНК при злокачественных опухолях (адаптировано из [20]).
Следует отметить, что некоторые нкРНК обладают двойственной ролью – то есть могут выступать и как онкосупрессоры и как онкогены, в зависимости от конкретного типа опухоли, то есть от клеточного и тканевого окружения. Например, микроРНК let-7 проявляет свойства онкогена при опухолях шейки матки, снижая экспрессию регулятора апоптоза Fas, но выступает как супрессор при немелкоклеточном раке лёгкого, подавляя экспрессию медиаторов клеточного цикла RAS и циклинов [4,16,18].
Некоторые примеры из множества некодирующих РНК, обладающих онкогенными, онкосупрессорными и двойственными свойствами показаны в Таблице 2.
Кроме того, микроРНК обладают способностью изменять чувствительность опухолей к химиотерапевтическим препаратам. Эта тема также активно изучается многими исследователями. Значительнее всего на чувствительность злокачественных клеток различных типов к химиотерапии влияют такие микроРНК, как miR-21, miR-26a/b, miR-125a/b, miR-203 и miR-218. Механизм их действия заключается преимущественно в регуляции экспрессии белков, вовлечённых в процесс апоптоза — BCL2, Survivin и PTEN [22]. Свою роль играет и воздействие других микроРНК на другие клеточные пути (Рис. 6).
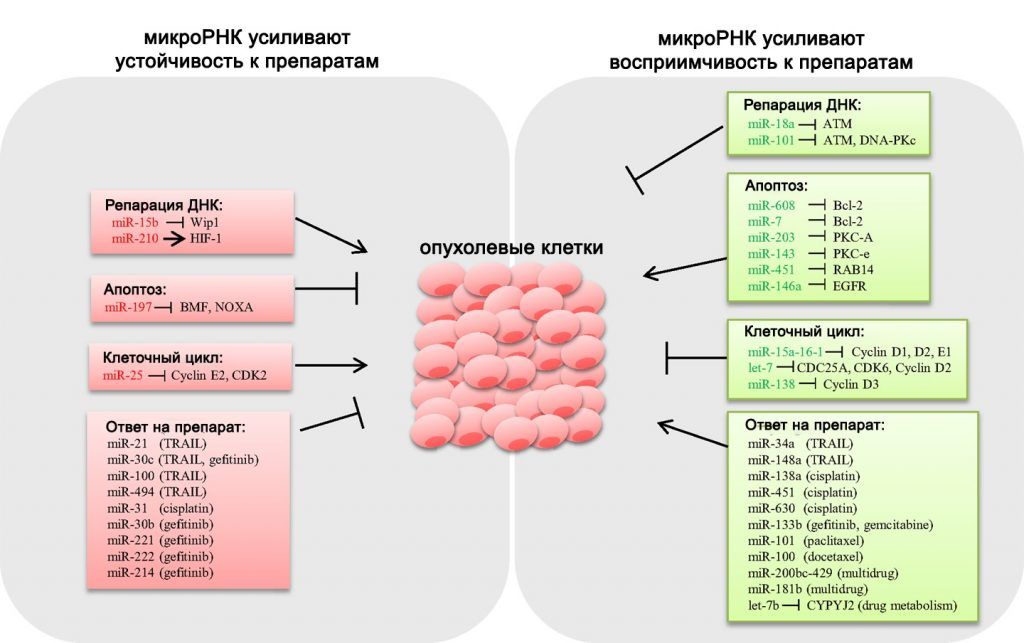
Рисунок 6 ❘ Влияние микроРНК на химиочувствительность опухолевых клеток (адаптировано из [23]).
Благодаря тому, что экспрессия регуляторных некодирующих РНК тканеспецифична, а их уровень изменяется во время патологических процессов, возможно использовать нкРНК в качестве диагностического и прогностического маркера. Точность диагностики по микроРНК значительно выше по сравнению с диагностикой по мРНК-маркерам. Более того, в ряде случаев профиль экспрессии некодирующих РНК позволяет предсказать исход болезни [2]. К примеру, уровень длинной нкРНК LIPCAR изменяется при инфаркте миокарда, а определённые его значения указывают на высокий риск смерти пациента от сердечной недостаточности [24]. Для опухолей разной локализации и клеточного происхождения характерны специфичные профили экспрессии генов микроРНК. Например, набор из пяти миРНК (miR-25, miR-34c, miR-191, let-7e, miR-34a) позволяет различить основные гистологические типы немелкоклеточного рака легкого и может быть использован как маркер неблагоприятного прогноза [19]. Длинные нкРНК можно применять и для прогноза возможного развития опухолей: установлена ассоциация между генетическим вариантом длинной нкРНК Н19 и риском развития рака мочевого пузыря [3,16].
Самым многообещающим видом биомаркеров для диагностики заболеваний представляются внеклеточные (циркулирующие) микроРНК и длинные нкРНК, составляющие 42,3% и 3,4% всех внеклеточных РНК соответственно. При наличии патологического процесса в организме уровень маркерной нкРНК в крови может повышаться более чем в десятки раз по сравнению с нормальным. Диагностически значимые микроРНК выявляются не только в цельной крови, но и в плазме и сыворотке крови, слюне, моче, пищеварительных соках и других жидкостях, выделяемых организмом человека [25].
В биологических жидкостях регуляторные РНК могут присутствовать в крови в одной из трёх форм:
- микроРНК и длинные нкРНК из повреждённых тканей;
- микроРНК и длинные нкРНК, заключённые в мембранные пузырьки — экзосомы или апоптозные тельца;
- микроРНК в комплексе с мРНК-связывающим белком (липопротеины высокой плотности, нуклеофосмин 1, белки семейства Argonaute и т. д.) [15,25,26].
Диагностика заболеваний по внеклеточным РНК обладает следующими преимуществами:
- Циркулирующие нкРНК очень стабильны, в том числе в экстремальных условиях, включая высокие температуры, высокий или низкий рН и циклы заморозки – разморозки.
- РНК легко обнаружить в образцах тканей и жидкостей таким методом, как количественная ПЦР с обратной транскрипцией (qRT-PCR).
- Уровень нкРНК, циркулирующих в жидкостях человеческого тела, изменяется соответственно уровню аналогичных нкРНК в тканях.
- Получение клинических образцов, которые содержат циркулирующие нкРНК – малоинвазивный и простой процесс [11, 26].
Наиболее эффективным методом для определения уровня циркулирующих микроРНК в биологических жидкостях является количественная ПЦР с обратной транскрипцией. Она обладает высокой чувствительностью и позволяет оценивать динамику изучаемого показателя. Единственным её недостатком является ограничение по числу одновременно анализируемых образцов. Другие методы, такие как микрочиповые технологии или различные виды секвенирования обладают большей пропускной способностью, однако микрочиповой метод не позволяет проводить точную количественную оценку измеряемого показателя, а секвенирование, как правило, экономически неэффективно [18].
Метод qRT-PCR позволяет успешно диагностировать некоторые виды рака, выявляя в различных биологических жидкостях нкРНК, попадающие туда из распавшихся тканей злокачественных опухолей или секретируемые переродившимися клетками в виде экзосом – пузырьков, окружённых мембраной [15]. Экзосомы доставляют регуляторные белки и РНК от одних клеток к другим, тем самым индуцируя апоптоз или же стимулируя рост раковых клеток [6]. Примеры нкРНК, способных выступать в роли диагностических маркеров при злокачественных опухолях, приведены в Таблице 3.
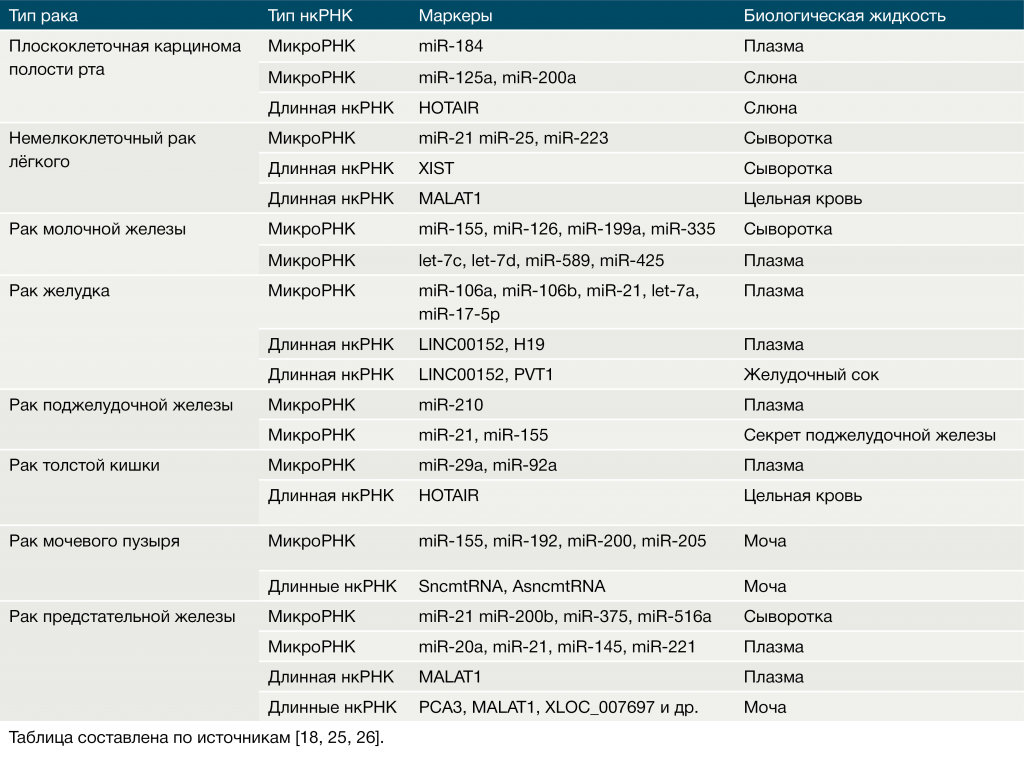
Таблица 3 ❘ Циркулирующие нкРНК как биомаркеры различных видов рака.
Вовлечённость некодирующих РНК в развитие заболеваний позволяет разрабатывать не только методы диагностики, но и новые способы терапии. Если установлено, что при развитии заболевания в клетке возникает нехватка какой-либо микроРНК, то необходимо повысить её уровень (Рис.7). Однако, непосредственное введение микроРНК или сходных по механизму действия коротких интерферирующих РНК небезопасно. В клеточных культурах и in vivo показано, что киРНК обладают дозозависимой токсичностью и вызывают повреждение печени у мышей. Поэтому, для повышения уровня микроРНК, необходимо применять обходные пути.
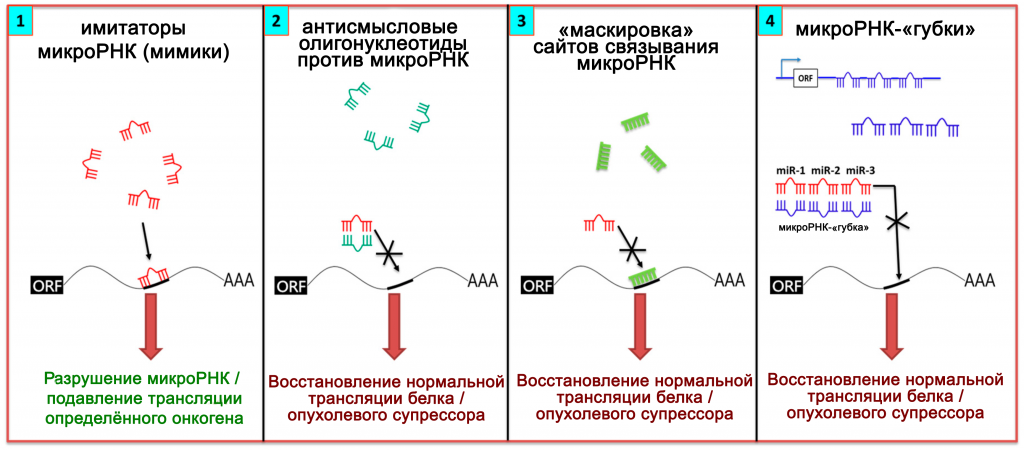
Рисунок 7 ❘ Возможности терапии с помощью нкРНК [27].
В том случае, когда транскрипция гена микроРНК подавлена из-за его избыточного метилирования, экспрессию можно восстановить с помощью деметилирующих препаратов. Можно применить и искусственные молекулы, способные действовать как малые нкРНК. В 2009 году были созданы имитаторы микроРНК – малые дцРНК, которые ингибируют трансляцию специфических генов-мишеней [11].
Имитируют действие микроРНК и одноцепочечные олигонуклеотиды, комплементарные мРНК-мишеням. Из-за комплементарности и антипараллельности смысловой мРНК, такие препараты называют антисмысловыми олигонуклеотидами (АСО). Соединяясь с мРНК, АСО образуют двуцепочечные РНК. В итоге мРНК либо утрачивает способность к трансляции, либо расщепляется в результате РНК-интерференции. Примером такого препарата, уже применяющегося для лечения, является мипомерсен (mipomersen). Он используется в качестве вспомогательной терапии при гомозиготной семейной гиперхолестеринемии. Механизм действия мипомерсена – снижение уровня мРНК аполипопротеина В, что снижает и уровень атерогенного холестерина в плазме [28].
Следует отметить, что одноцепочечные олигонуклеотиды заряжены отрицательно и обладают гидрофильностью, поэтому сами не могут преодолеть гидрофобную клеточную мембрану, к тому же они быстро подвергаются расщеплению ферментами. Поэтому для облегчения доставки изменяют химическую структуру олигонуклеотидов или внедряют их во вспомогательные молекулярные комплексы — вирусные частицы или липосомы. Однако применение вирусных методов in vivo ограничено высокой иммуногенностью вирусных белков и вероятностью их внедрения в нежелательные места генома [11].
Наиболее безопасным и эффективным методом является химическая модификация антисмысловых олигонуклеотидов. Подробнее о видах такой модификации, препарате мипомерсен, а также о фармакологических свойствах антисмысловых препаратов можно прочитать в статье "Фармакология антисмысловых препаратов"
Если доказано, что микроРНК играет центральную роль в патогенезе заболевания или снижает чувствительность к терапии, её уровень в клетке требуется понизить. Для этой цели применяют, например, некоторые длинные нкРНК (микроРНК-«губки»), которые способны одновременно связывать несколько микроРНК со сходной последовательностью и препятствовать их взаимодействию с мишенями [4]. Экспрессия мРНК-мишеней при этом увеличивается [2]. В модели на животных «губки», захватывающие miR-277 успешно блокировали нейродегенерацию при синдроме тремора и/или атаксии, связанных с ломкой Х-хромосомой (FXATS) [11, 29].
Несколькими исследовательскими группами созданы АСО, которые могут связываться не с мРНК, а с длинными нкРНК или микроРНК [2]. В 2009 г. на основе модифицированных олигонуклеотидов разработан таргетный препарат миравирсен, ингибирующий miR-122, необходимую для репликации вируса гепатита С. Препарат успешно прошёл все клинические испытания и уже применяется в клинике [28].
Множество других антисмысловых препаратов для лечения широкого спектра заболеваний находятся на различных фазах клинических испытаний и все они являются весьма многообещающими. Не исключено, что дальнейшее выяснение функциональной роли некодирующих РНК в норме и при патологии позволит выявить новые диагностические маркеры и разработать принципиально новые терапевтические препараты, открывая новые перспективные возможности для медицины будущего.
Источники:
- http://www.gencodegenes.org/stats/current.html
- Макарова Ю. А., Крамеров Д. А. Некодирующие РНК (обзор) // Биохимия. – 2007. – Т. 72. – №. 11. – С. 1427-1448.
- Paralkar V. R., Weiss M. J. Long noncoding RNAs in biology and hematopoiesis // Blood. – 2013. – Т. 121. – №. 24. – С. 4842-4846.
- Засухина Г. Д., Михайлов В.Ф., Шуленина Л.В., Васильева И.М. Роль некодирующих РНК в клетках человека после воздействия ионизирующей радиации // Цитология. – 2017. – Т. 59. – №. 9.
- http://trna.bioinf.uni-leipzig.de
- Ситиков А. С. Антисмысловые РНК как посланники в межклеточной коммуникации: 20 лет спустя //Успехи биологической химии. – 2012. – С. 157-176.
- Morceau F. et al. Long and short non-coding RNAs as regulators of hematopoietic differentiation //International journal of molecular sciences. – 2013. – Т. 14. – №. 7. – С. 14744-14770.
- http://slideplayer.com/slide/3373325/
- https://naked-science.ru/article/sci/genetiki-sostavili-tochnyy-atlas
- lectoriy.mipt.ru/file/synopsis/pdf/Biology-Molecular-M05-Skoblov-141001.01.pdf
- Тигунцев В.В., Иванова С.А., Серебров В.Ю., Бухарева М.Б. Малые некодирующие РНК как перспективные биомаркеры: биогенез и терапевтические стратегии //Бюллетень сибирской медицины. – 2016. – Т. 15. – №. 2.
- https://images.nigms.nih.gov/Pages/DetailPage.aspx?imageID2=2559
- https://biomolecula.ru/articles/obo-vsekh-rnk-na-svete-bolshikh-i-malykh
- lectoriy.mipt.ru/file/synopsis/pdf/Biology-Molecular-M04-Skoblov-140924.01.pdf
- Melo S. A. et al. Cancer exosomes perform cell-independent microRNA biogenesis and promote tumorigenesis //Cancer cell. – 2014. – Т. 26. – №. 5. – С. 707-721.
- Щербо С. Н., Щербо Д. С. Биомаркеры персонализированной медицины //Медицинский алфавит. – 2013. – Т. 4. – №. 22. – С. 7-9.
- Liu Y., Zheng L., Wang Q., Hu Y. W. Emerging roles and mechanisms of long noncoding RNAs in atherosclerosis //International journal of cardiology. – 2016.
- Chandra Gupta S., Nandan Tripathi Y. Potential of long non‐coding RNAs in cancer patients: From biomarkers to therapeutic targets //International journal of cancer. – 2017. – Т. 140. – №. 9. – С. 1955-1967.
- Логинов В. И. и др. Метилирование генов микроРНК и онкогенез (обзор) //Биохимия. – 2015. – Т. 80. – №. 2. – С. 184-203.
- Inamura K. Major Tumor Suppressor and Oncogenic Non-Coding RNAs: Clinical Relevance in Lung Cancer //Cells. – 2017. – Т. 6. – №. 2. – С. 12.
- Hamano R., Ishii H., Miyata H., Doki Y., Mori M. Role of microRNAs in solid tumors //Journal of Nucleic Acids Investigation. – 2011. – Т. 2. – №. 1. – С. 2.
- Çalışkan M., Güler H., Çetintaş V. B. Current updates on microRNAs as regulators of chemoresistance //Biomedicine & Pharmacotherapy. – 2017. – Т. 95. – С. 1000-1012.
- Naidu S., Garofalo M. microRNAs: An emerging paradigm in lung cancer chemoresistance //Frontiers in medicine. – 2015. – Т. 2.
- Kumarswamy R. et al. The circulating long non-coding RNA LIPCAR predicts survival in heart failure patients //Circulation research. – 2014. – С. CIRCRESAHA. 114.303915.
- Chakraborty C., Das S. Profiling cell-free and circulating miRNA: a clinical diagnostic tool for different cancers //Tumor Biology. – 2016. – Т. 37. – №. 5. – С. 5705-5714.
- Shi T., Gao G., Cao Y. Long noncoding RNAs as novel biomarkers have a promising future in cancer diagnostics //Disease markers. – 2016. – Т. 2016.
- Beyer S. et al. The Role of miRNAs in Angiogenesis, Invasion and Metabolism and Their Therapeutic Implications in Gliomas //Cancers. – 2017. – Т. 9. – №. 7. – С. 85.
- Bennett C. F. et al. Pharmacology of antisense drugs //Annual review of pharmacology and toxicology. – 2017. – Т. 57. – С. 81-105.
- Tan H. et al. MicroRNA-277 modulates the neurodegeneration caused by Fragile X premutation rCGG repeats //PLoS genetics. – 2012. – Т. 8. – №. 5. – С. e1002681.
