Третичные лимфоидные структуры в атеросклеротических бляшках человека

Открытие третичных лимфоидных органов в атеросклеротических бляшках (ТЛОАБ) человека подчеркивает роль иммунной системы в патогенезе атеросклероза. Ученые исследуют клеточные и молекулярные особенности ТЛОАБ; предполагается, что ТЛОАБ являются одной из причин нестабильности бляшек вследствие активации адаптивных иммунных реакций.
Третичные лимфоидные органы (ТЛО) представляют собой скопления лимфоидных клеток без капсулы, наблюдаемые при злокачественных новообразованиях [1] и иных хронических заболеваниях [2]. Атеросклероз, будучи основной причиной сердечно-сосудистых заболеваний и смертности во всем мире, характеризуется образованием бляшек в интиме артериальной стенки. В составе бляшек находятся липиды, макрофаги и прочие иммунные клетки. В адвентиции, которая расположена под бляшками, агрегаты В-клеток и других иммунных клеток были зафиксированы еще в 2001 году [3]. Такие скопления, вероятно, представляют собой предшественников структурированных третичных лимфоидных органов артерий (ТЛОА).
У старых мышей с гиперлипидемией и дефицитом аполипопротеина E (Apoe−/−) (возрастом более 32 недель и страдающие атеросклеротическим поражением брюшной аорты) гладкомышечные клетки (ГМК) слоя медии (т. е. расположенные под бляшками интимы) активируются вследствие сигналинга, зависимого от рецептора лимфотоксина β (LTβR) и рецептора фактора некроза опухоли 1 (TNFR1). Это запускает экспрессию лимфоорганогенных хемокинов (CXCL13 и CCL21), стимулирующих формирование зрелых третичных лимфоидных органов аорты (ТЛОАо), которые развиваются в соединительной ткани адвентициальной оболочки [4]. ТЛОАо состоят из герминативного центра (ГЦ) в фолликулах В-клеток, скоплений плазматических клеток и наружных эпителиальных венул в области Т-клеток и большого количества регуляторных Т-клеток. Клональная экспансия Т-клеток в ТЛОАо позволяет предположить, что они могут быть местом, где нарушается аутотолерантность — процесс, который запускает аутоиммунные реакции при атеросклерозе [5].
В своей работе в Nature Cardiovascular Research Lai с соавт. [6] сообщают об открытии ТЛО в атеросклеротических бляшках человека. Используя передовые методы пространственной транскриптомики и транскриптомики на уровне единичных клеток, им удалось создать первый транскриптомный атлас, где представлено исчерпывающее описание клеточного содержимого и молекулярного профиля ТЛОАБ у человека.
Пространственная транскриптомика — это инновационный метод, благодаря которому возможно создавать карты экспрессии генов высокого разрешения, сохраняя пространственный контекст ткани и предоставляя важный уровень информации, недоступный при традиционном bulk-секвенировании [7]. Благодаря секвенированию РНК отдельных клеток (scRNA-seq) возможно получить глобальный атлас атеросклеротических бляшек, выявляя редкие популяции клеток и профиль экспрессии их генов [8, 9]. Ключевым ограничением метода scRNA-seq является то, что он не способен сохранять пространственную конфигурацию. Пространственная транскриптомика решает эту проблему, объединяя молекулярную информацию высокого разрешения с подробностями о пространственной организации клеток в ткани. Однако огромный объем данных, полученных с помощью пространственной транскриптомики, — значительный вызов, и анализ этого массива требует серьезных навыков в области биоинформатики [10].
Lai с соавт. [6] воспользовались scRNA-seq и Stereo-seq (от англ. spatial enhanced resolution omics-sequencing — омикс-секвенирование с улучшенным пространственным разрешением) в сочетании с чипами массива ДНК-наношариков (ДНШ) и захватом РНК in situ для создания транскриптомного атласа отдельных клеток атеросклеротических бляшек.
В исследование вошли 143 пациента с симптоматическим и бессимптомным стенозом сонной артерии. Для scRNA-seq использовались 10 бляшек сонной артерии, полученных от 9 пациентов, перенесших каротидную эндартерэктомию. Для Stereo-seq было выполнено 10 срезов бляшек сонной артерии от 7 пациентов, транскрипты были отнесены к отдельным клеткам с использованием окрашивания ДНК и сегментации по морфологическим водоразделам. Затем срезы соседних тканей были окрашены гематоксилином и эозином (H&E). Транскрипционные сигнатуры, полученные в итоге scRNA-seq, использовались для классификации 304865 клеток, сегментированных под контролем в срезах Stereo-seq с разрешением bin 50 (50× 50 ДНШ, 25 мкм).
Это означает, что транскрипты из 50 × 50 ДНШ агрегировались и группировались вместе в один более крупный кластер, охватывающий бОльшую пространственную область 25 × 25 мкм. Кроме того, была выполнена сегментация клеток с использованием визуализации для точной интеграции ДНК и транскриптов в управляемую [визуализационно] матрицу (каждый ген к отдельной клетке). Затем окрашенные срезы тканей использовались для определения типа клеток, чтобы соотнести [пространственную] организацию каждой бляшки с секциями Stereo-seq.
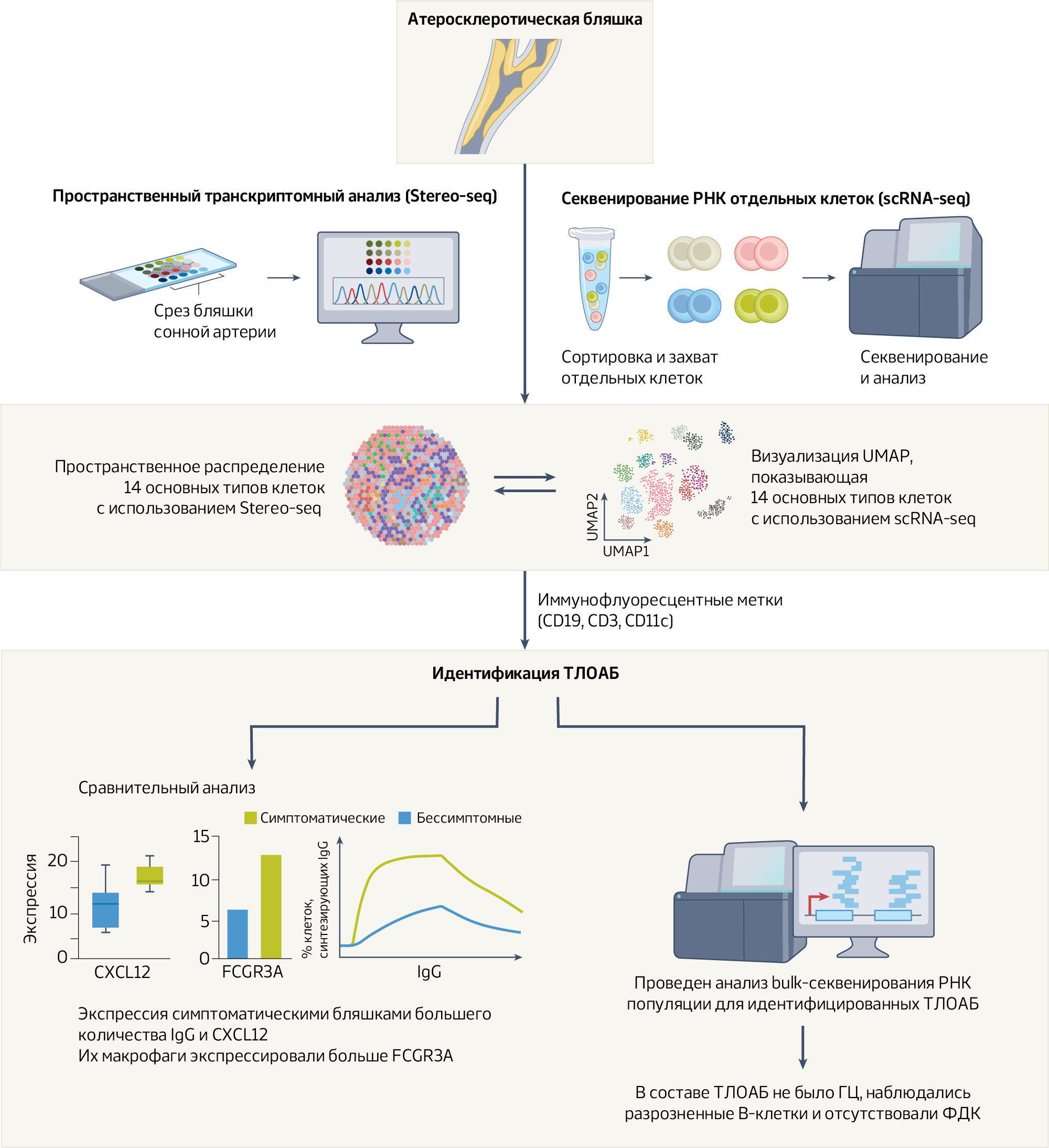
В результате анализа было выявлено широкое распространение лимфоидных клеток в атеросклеротических бляшках, образующих агрегаты в определенных областях. По итогу патоморфологического анализа с помощью окрашивания H&E и тройной иммунофлюоресцентной маркировки маркерами ТЛО было подтверждено, что эти агрегаты являются ТЛО. Внутри идентифицированных ТЛОАБ наблюдалась выраженная кластеризация плазматических клеток и В-клеток, в отличие от других областей бляшек, где содержалось больше макрофагов и ГМК. Более того, профиль экспрессии генов ТЛОАБ продемонстрировал явные различия по сравнению с другими ТЛО на разных стадиях [их формирования], что указывает на специфический транскрипционный профиль ТЛОАБ. У ТЛОАБ не наблюдалась экспрессия некоторых маркерных генов зрелых ТЛО (таких как BCL6, CD21 и CD23), а это означает, что ТЛОАБ могут быть незрелой формой ТЛО. В отличие от зрелых ТЛО у ТЛОАБ также отсутствовали отличительные особенности ГЦ, поскольку фиксировались лишь разрозненные BCL6+ В-клетки, без CD21+ фолликулярных дендритных клеток (ФДК). Эти результаты свидетельствуют о том, что ТЛОАБ являются наименее организованной стадией формирования ТЛО.
В ходе исследования выяснилось, что, вероятно, фибробластоподобные гладкомышечные клетки (ФГМК) являются ключевыми регуляторами формирования ТЛОАБ. У этих клеток наблюдалась повышенная экспрессия лимфоорганогенных хемокинов CXCL12 и CCL19, которые играют решающую роль в привлечении иммунных клеток (В- и Т-клеток) к ТЛОАБ. ФГМК в изобилии экспрессируют VCAM-1 — молекулы адгезии, которые способствуют привлечению и удержанию иммунных клеток в бляшках. Иммунофлуоресцентный анализ также подтвердил высокий процент ФГМК в бляшках ТЛОАБ+, что предполагает их участие в формировании ТЛОАБ.
Другим важным выводом этого исследования является потенциал иммунного взаимного влияния ТЛОАБ и периваскулярной жировой ткани (ПВЖТ). В нормальных условиях артериальный гладкомышечный слой (медия) является привилегированным в иммунологическом отношении участком, лишенным иммунных клеток. В ходе данного исследования была выявлена крайне разнообразная популяция В-клеток в ТЛОАБ, что свидетельствовало о потенциальном нарушении этой иммунной привилегии и, как следствие, выраженном скоплении иммунных клеток в ТЛОАБ. Для дальнейшего изучения этой возможности исследователи провели scRNA-seq бляшек, ПВЖТ и образцов крови от тех же пациентов. Они обнаружили, что В-клетки и плазматические клетки в ПВЖТ и ТЛОАБ обладают высоким транскрипционным сходством, что предполагает возможную миграцию В-клеток между этими двумя компартментами. Кроме того, отслеживание мутаций митохондриальной РНК подтвердило наличие общих клонов В-клеток в ПВЖТ и ТЛОАБ.
Путем сравнения клинических данных, источников иммунных клеток и особенностей ТЛОАБ Lai с соавт. [6] продемонстрировали, что, скорее всего, ТЛОАБ являются причиной нестабильности бляшек, активируя адаптивный иммунитет. Сравнительный анализ бляшек у пациентов с проявлениями атеросклероза и без таковых показал, что ТЛОАБ у первых содержит большое количество активных плазматических клеток, секретирующих антитела IgG, в сочетании с повышенной экспрессией рецептора Fcγ (FCGR3A) на макрофагах, повышенным титром CXCL12 и повышенным количеством макрофагов IgG+ CD16+ (рис. 1). Это означает, что макрофаги могут быть эффекторными клетками при воспалительных процессах, потенциально вовлеченными в дестабилизацию бляшек. Таким образом, таргетное воздействие на них может стать важной терапевтической стратегией стабилизации и предотвращения прогрессирования бляшек.
Более того, даже после корректировки известных факторов риска атеросклероза с помощью модели логистической регрессии и многофакторного анализа авторы отметили, что наличие ТЛОАБ в значительной степени коррелирует с симптоматическими атеросклеротическими бляшками (скорректированное отношение шансов (ОШ) 3,5, 95 % доверительный интервал (ДИ) 1,365–8,982, P = 0,009). Эти результаты свидетельствуют о том, что ТЛОАБ могут быть независимым фактором риска клинических симптомов атеросклероза сонных артерий. В настоящее время это корреляционный анализ, и необходимо дальнейшее изучение механизма.
Хотя транскриптомика отдельных клеток и пространственное картирование предоставляют ценные сведения о ТЛОАБ, анализ остается описательным. Одной из областей будущих исследований может быть обнаружение специфических антигенов, распознаваемых IgG-антителами, которые, по всей видимости, образуются в ТЛОАБ. Такие открытия также дадут информацию о потенциальных стратегиях терапии. Чтобы выяснить, происходят ли В-клетки в составе ТЛОАБ из ПВЖТ, авторы исследовали мононуклеарные клетки периферической крови (МКПК), ПВЖТ и бляшки. Однако исследование не дает подробный ответ о том, при каких обстоятельствах и откуда были получены образцы ПВЖТ, а также в нем не упоминается, было ли проведено сравнение МКПК между пациентами. Кроме того, в ходе будущих экспериментов по определению зависимости прогрессирования заболевания от времени можно было бы напрямую рассмотреть развитие бляшек на соответствующих животных моделях атеросклероза.
Обобщая вышесказанное, исследование дает представление об особенностях, функциях и клинической манифестации ТЛОАБ, а также формирует точку зрения на роль иммунной системы в сердечно-сосудистых заболеваниях, связанных с атеросклеротическим поражением.
